《九年級(jí)化學(xué) 中考專題復(fù)習(xí) 專題3 酸堿鹽一 人教新課標(biāo)版》由會(huì)員分享���,可在線閱讀���,更多相關(guān)《九年級(jí)化學(xué) 中考專題復(fù)習(xí) 專題3 酸堿鹽一 人教新課標(biāo)版(4頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
1���、九年級(jí)化學(xué) 中考專題復(fù)習(xí) 專題3 酸堿鹽一 人教新課標(biāo)版
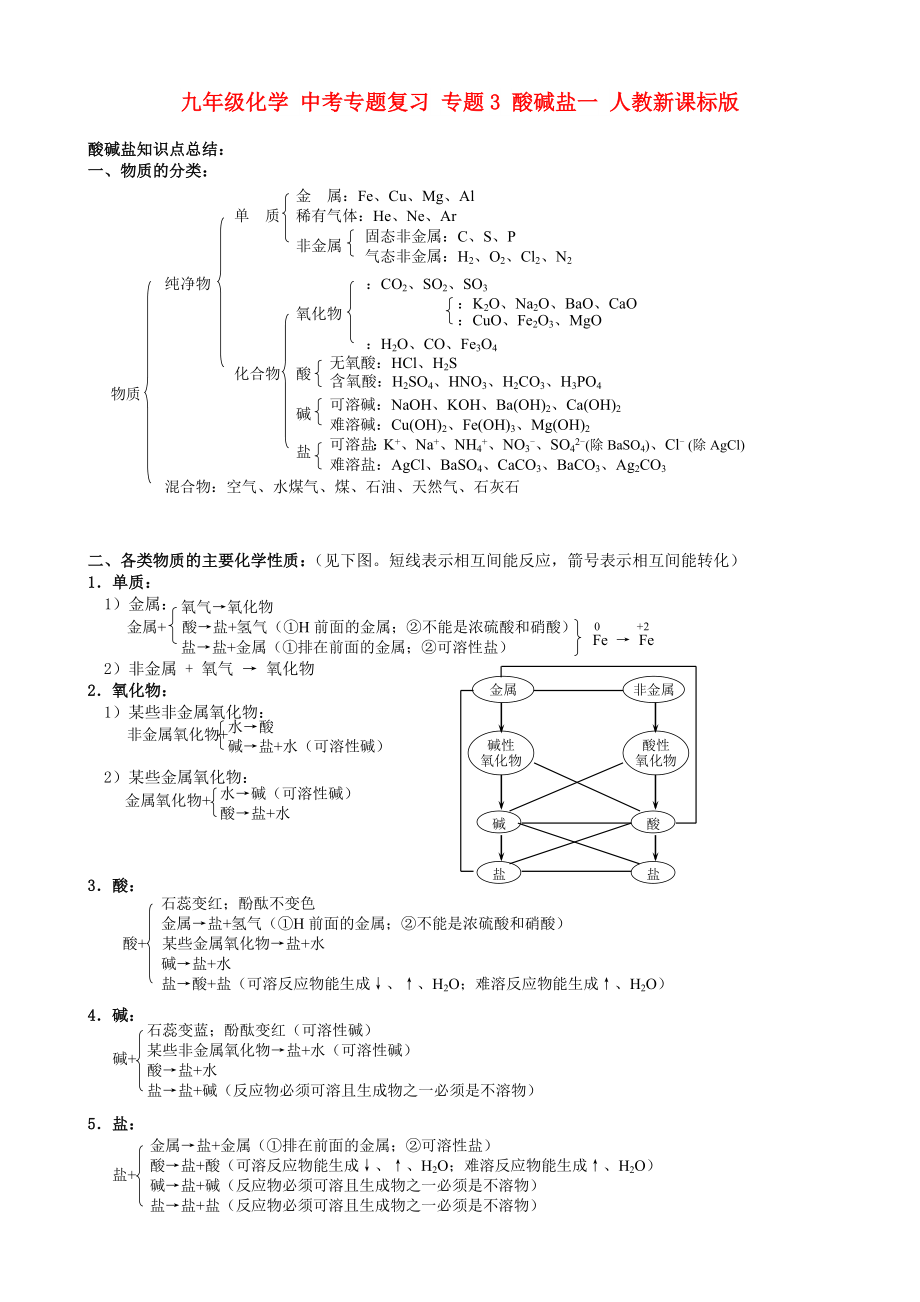
酸堿鹽知識(shí)點(diǎn)總結(jié):
一���、物質(zhì)的分類:
金 屬:Fe、Cu���、Mg���、Al
單 質(zhì) 稀有氣體:He���、Ne、Ar
非金屬
純凈物 :CO2���、SO2���、SO3
氧化物
:H2O、CO���、
2���、Fe3O4
化合物 酸
物質(zhì)
堿
鹽
混合物:空氣、水煤氣���、煤���、石油、天然氣���、石灰石
可溶鹽:K+���、Na+���、NH4+、NO3-���、SO42-(除BaSO4)���、Cl- (除AgCl)
難溶鹽:AgCl���、BaSO4���、CaCO3、BaCO3���、Ag2CO3
可溶堿:NaOH���、KOH、Ba(OH)2���、Ca(OH)2
難溶堿:Cu(OH)2���、Fe(OH)3���、Mg(OH)2
無(wú)氧酸:HCl、H2S
含氧酸:H2SO4���、HNO3���、H
3、2CO3���、H3PO4
:K2O���、Na2O、BaO���、CaO
:CuO���、Fe2O3、MgO
固態(tài)非金屬:C���、S���、P
氣態(tài)非金屬:H2���、O2、Cl2���、N2
二���、各類物質(zhì)的主要化學(xué)性質(zhì):(見(jiàn)下圖。短線表示相互間能反應(yīng)���,箭號(hào)表示相互間能轉(zhuǎn)化)
1.單質(zhì):
0 +2
Fe → Fe
氧氣→氧化物
金屬+ 酸→鹽+氫氣(①H前面的金屬;②不能是濃硫酸和硝酸)
鹽→鹽+金屬(①排在前面的金屬���;②可溶性鹽)
1)金屬:
金屬
堿性
氧化物
堿
鹽
非金屬
4���、
酸性
氧化物
酸
鹽
2)非金屬 + 氧氣 → 氧化物
2.氧化物:
非金屬氧化物+
水→酸
堿→鹽+水(可溶性堿)
1)某些非金屬氧化物:
金屬氧化物+
水→堿(可溶性堿)
酸→鹽+水
2)某些金屬氧化物:
石蕊變紅;酚酞不變色
金屬→鹽+氫氣(①H前面的金屬���;②不能是濃硫酸和硝酸)
酸+ 某些金屬氧化物→鹽+水
堿→鹽+水
鹽→酸+鹽(可溶反應(yīng)物能生成↓���、↑���、H2O;難溶反應(yīng)物能生成↑���、H2O)
3.酸:
石蕊變藍(lán)���;酚酞變紅(可溶性堿)
某
5、些非金屬氧化物→鹽+水(可溶性堿)
酸→鹽+水
鹽→鹽+堿(反應(yīng)物必須可溶且生成物之一必須是不溶物)
堿+
4.堿:
5.鹽:
金屬→鹽+金屬(①排在前面的金屬���;②可溶性鹽)
酸→鹽+酸(可溶反應(yīng)物能生成↓���、↑、H2O���;難溶反應(yīng)物能生成↑���、H2O)
堿→鹽+堿(反應(yīng)物必須可溶且生成物之一必須是不溶物)
鹽→鹽+鹽(反應(yīng)物必須可溶且生成物之一必須是不溶物)
鹽+
三、化學(xué)反應(yīng)的基本類型:
1)化合反應(yīng):(有單質(zhì)時(shí)化合價(jià)改變)
⑴單質(zhì)+單質(zhì)→化合物 Mg + O
6���、2 —— P + O2 ——
⑵單質(zhì)+化合物→化合物 C + CO2 ——
⑶化合物+化合物→化合物 CaO + H2O ——
2)分解反應(yīng):(有單質(zhì)時(shí)化合價(jià)改變)
⑴氧化物分解 H2O —— H2O 2——
⑵酸分解 H2CO3 ——
⑶鹽分解 KMnO4 —— KClO3 ——
CaCO3 ——
7���、
3)置換反應(yīng):(化合價(jià)一定改變)
⑴金屬+酸→鹽+氫氣(①H前面的金屬���;②不能是濃硫酸和硝酸)
Fe + HCl — Al + H2SO4 —
⑵金屬+鹽→鹽+金屬(①排在前面的金屬;②可溶性鹽)
Fe + CuSO4 — Cu + AgNO3 —
⑶金屬氧化物+H2(或C)→金屬+水(或CO2)
CuO + H2 — C + Fe2O3 ——
4)復(fù)分解反應(yīng):(化合價(jià)一定不變)
⑴堿性氧化物(某些金屬
8���、氧化物)+酸→鹽+水
Fe2O3 + HCl — CuO + H2SO4 —
⑵酸+堿→鹽+水
NaOH + H2SO4 — Fe(OH)3 + HCl —
⑶酸+鹽→鹽+酸(可溶反應(yīng)物能生成↓���、↑、H2O���;難溶反應(yīng)物能生成↑���、H2O)
H2SO4 + BaCl2 — HCl + CaCO3 —
⑷堿+鹽→堿+鹽(反應(yīng)物必須可溶且生成物之一必須是不溶物)
Ca(OH)2 + Na2CO3 —
9、NaOH + FeCl3 —
⑸鹽+鹽→鹽+鹽(反應(yīng)物必須可溶且生成物之一必須是不溶物)
CaCl2 + K2CO3 — Ba(NO3)2 + Na2SO4 —
※不屬于四種基本類型的反應(yīng):
⑴金屬氧化物+CO→金屬+CO2 Fe2O3 + CO ——
⑵堿+酸性氧化物(某些非金屬氧化物)→鹽+水(可溶性堿) NaOH + CO2 —
⑶有機(jī)物+O2→H2O+CO2 C2H5OH + O2 ——
☆氧化還原反應(yīng):
得到氧的物質(zhì)被氧化���,發(fā)生氧化反應(yīng),是還原劑���;
失去氧的物質(zhì)被還原
10���、,發(fā)生還原反應(yīng)���,是氧化劑���。
如:在2Mg+CO2 點(diǎn)燃 2MgO+C中���, 是氧化劑, 是還原劑���, 被氧化���,
被還原。
+1 -1 -2 -2 -1
NH4Cl NaOH H2SO4 H2CO3 HNO3
11���、
銨根 氫氧根 硫酸根 碳酸根 硝酸根
銨根中N為-3價(jià)���;硫酸根中S為+6價(jià);碳酸根中C為+4價(jià)���;硝酸根中N為+5價(jià)���。
☆常見(jiàn)的原子團(tuán)及其化合價(jià):
四、金屬活動(dòng)性順序和復(fù)分解反應(yīng)發(fā)生的條件:
1.金屬活動(dòng)性順序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
⑴判斷金屬與酸反應(yīng)時(shí):金屬必須排在(H)前
12、面���;酸不可用硝酸和濃硫酸���。
⑵判斷金屬與鹽反應(yīng)時(shí):必須同時(shí)滿足①排在前面的金屬;②可溶性鹽���。
2.復(fù)分解反應(yīng)發(fā)生的條件:生成物中有沉淀或氣體或水
AgCl
BaSO4
難溶性鹽 CaCO3
BaCO3
Ag2CO3
Mg(OH)2
難溶性堿 Cu(OH)2
Fe(OH)3
(白色)
(白色)
(白色)
(白色)
(白色)
(藍(lán)色)
(紅褐色)
可溶于酸
難溶于酸
☆復(fù)分解反應(yīng)生成的沉淀:
13���、
五、物質(zhì)的鑒別���、鑒定(檢驗(yàn))���、提純(除雜)、分離:
☆檢驗(yàn)物質(zhì)的試劑:
被檢物質(zhì)或離子
可選用的試劑
CO2
Ca(OH)2���;濕潤(rùn)的藍(lán)色石蕊試紙
NH3
濕潤(rùn)的紅色石蕊試紙
H+
石蕊試液���;Na2CO3
OH-
石蕊試液���;酚酞試液���;Cu2+���;Fe3+
Cl-
AgNO3+HNO3
SO42-
Ba2+{BaCl2、Ba(NO3)2���、Ba(OH)2}+ HNO3
CO32-
Ca2+{Ca(OH)2���、CaCl2、Ca(NO3)2}���;HCl
⑴鑒別:鑒別是將不同的物質(zhì)按其物理性質(zhì)或化學(xué)性質(zhì)的不同而加以辨別的過(guò)程���。
寫出鑒別下列各組物質(zhì)所需
14、的試劑或方法:
①鑒別Na2CO3和CaCO3: ②鑒別Na2SO4和NaCl:
③鑒別H2和CH4: ���、 ④鑒別Na2CO3和NaCl:
⑵鑒定(檢驗(yàn)):檢驗(yàn)是用一定的化學(xué)方法或物理方法將某種物質(zhì)確定出來(lái)的過(guò)程���。
寫出檢驗(yàn)下列各物質(zhì)所需的試劑或方法:
①鹽酸: 、 ②Fe2(SO4)3: ���、
①所加試劑只與雜質(zhì)反
15���、應(yīng)���,不與主要物質(zhì)反應(yīng);
除雜過(guò)程對(duì)所加試劑的要求: ②使雜質(zhì)轉(zhuǎn)化為易與主要物質(zhì)分離(即狀態(tài)不同)的物質(zhì)���;
③不能引入新的雜質(zhì)���。
⑶除雜:除雜是用物理或化學(xué)方法除去混合物中的雜質(zhì)的過(guò)程。
寫出除去下列各物質(zhì)中的雜質(zhì)所需的試劑或方法:
①除去MnO2中的KCl: ②除去NaOH中的Na2CO3:
⑷提純:提純是用物理或化學(xué)方法除去混合物中的雜質(zhì)除去并得到某純凈物的過(guò)程���。
寫出提純下列各物質(zhì)的實(shí)驗(yàn)步驟及所需的試劑或方法:
①?gòu)腒Cl與MnO2的混合物中提純KCl
16���、: 、 ���、
②從MgCl2與CaCl2的混合物中提純MgCl2: ���、 、 ���、
⑸分離:分離將混合物中的各成分用物理或化學(xué)方法分開(kāi)從而得到各純凈物的過(guò)程���。
寫出分離下列各物質(zhì)的實(shí)驗(yàn)步驟及所需的試劑或方法:
①分離KCl與MnO2的混合物; ②分離BaCl2與NaCl的混合物���。
六���、氣體的干燥:
①酸性干燥劑:濃硫酸、
⑴干燥劑 ②堿性干燥劑:固體CaO���、固體NaOH
③中性干燥劑:氯化鈣
17���、
①酸性氣體:CO2、SO2���、HCl
⑵氣體 ②堿性氣體:NH3
③中性氣體:H2���、O2、CH4���、CO
注意:酸性干燥劑不能用于干燥堿性氣體���;堿性干燥劑不能用于干燥酸性氣體���。
七、其他:
1.物質(zhì)的學(xué)名���、俗名及化學(xué)式:
⑴水銀���、汞、Hg
⑵金剛石���、石墨���、C;硫磺���、S���;紅磷、白磷���、P
⑶干冰���、固體CO2
⑷生石灰���、氧化鈣���、CaO���;氨氣、NH3(堿性氣體)
⑸鹽酸���、氫氯酸���、HCl;氫硫酸���、H2S���;亞硫酸、H2SO3
⑹熟石灰���、消石灰���、Ca(OH)2���;苛性鈉、燒堿���、火堿���、NaOH;氨水���、NH3
18���、·H2O(堿)
⑺純堿、蘇打Na2CO3���;碳酸氫鈉���、小蘇打、NaHCO3���;亞硝酸鈉���、NaNO2(工業(yè)用鹽)���;
⑻甲烷、CH4���;酒精���、乙醇���、C2H5OH���;醋酸、乙酸���、(冰醋酸)CH3COOH
2.常見(jiàn)混合物的主要成分:
煤:C���; 石油:C、H���、O元素 天然氣:CH4
水煤氣:H2���、CO 石灰石���、大理石:CaCO3 石灰水、石灰乳���、石灰漿:Ca(OH)2
3.常見(jiàn)物質(zhì)的顏色:
△ 白色固體:MgO���、P2O5、CaO���、NaOH���、Ca(OH)2、KClO3���、KCl���、Na2CO3、NaCl���、無(wú)水CuSO4
△ 銀白色:鎂���、
19���、鋁、鋅���、鐵���、汞(液態(tài))
△ 黑色固體:石墨、炭粉���、鐵粉、CuO���、MnO2���、Fe3O4
△ 紅色固體:Cu、Fe2O3 ���、HgO���、紅磷
△ 藍(lán)色晶體:CuSO4·5H2O
△ KMnO4為暗紫色
△ 硫:淡黃色
4.溶液的顏色:
△ 含Cu2+的溶液呈藍(lán)色(CuCl2溶液為藍(lán)綠色)���;
△ 含F(xiàn)e2+的溶液呈淺綠色;
△ 含F(xiàn)e3+的溶液呈黃色���;
△ 其余溶液一般為無(wú)色���。(高錳酸鉀溶液為紫紅色)
5溶于水放熱的物質(zhì):CaO、NaOH固體���、濃H2SO4
6刺激性氣味的氣體:NH3���、SO2、HCl(均無(wú)色)
▲刺激性氣味的液體:鹽酸���、硝酸���、醋酸
▲酒精為有特殊氣體的液體
7有毒的物質(zhì):CO、CH3OH���、NaNO2���、Cu2+(如CuSO4)���、Ba2+(如BaCl2)
8氮肥的含氮量:
NH4HCO3 17.7%;(NH4)2SO4 21.2%���;NH4Cl 26.2%���;NH4NO3 35%;尿素CO(NH2)2 46.7%
 九年級(jí)化學(xué) 中考專題復(fù)習(xí) 專題3 酸堿鹽一 人教新課標(biāo)版
九年級(jí)化學(xué) 中考專題復(fù)習(xí) 專題3 酸堿鹽一 人教新課標(biāo)版