《2019版高考化學(xué)總復(fù)習(xí)專題鈉的氧化物——氧化鈉與過氧化鈉導(dǎo)學(xué)案》由會(huì)員分享,可在線閱讀��,更多相關(guān)《2019版高考化學(xué)總復(fù)習(xí)專題鈉的氧化物——氧化鈉與過氧化鈉導(dǎo)學(xué)案(6頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1、鈉的氧化物——氧化鈉與過氧化鈉
考點(diǎn)剖析
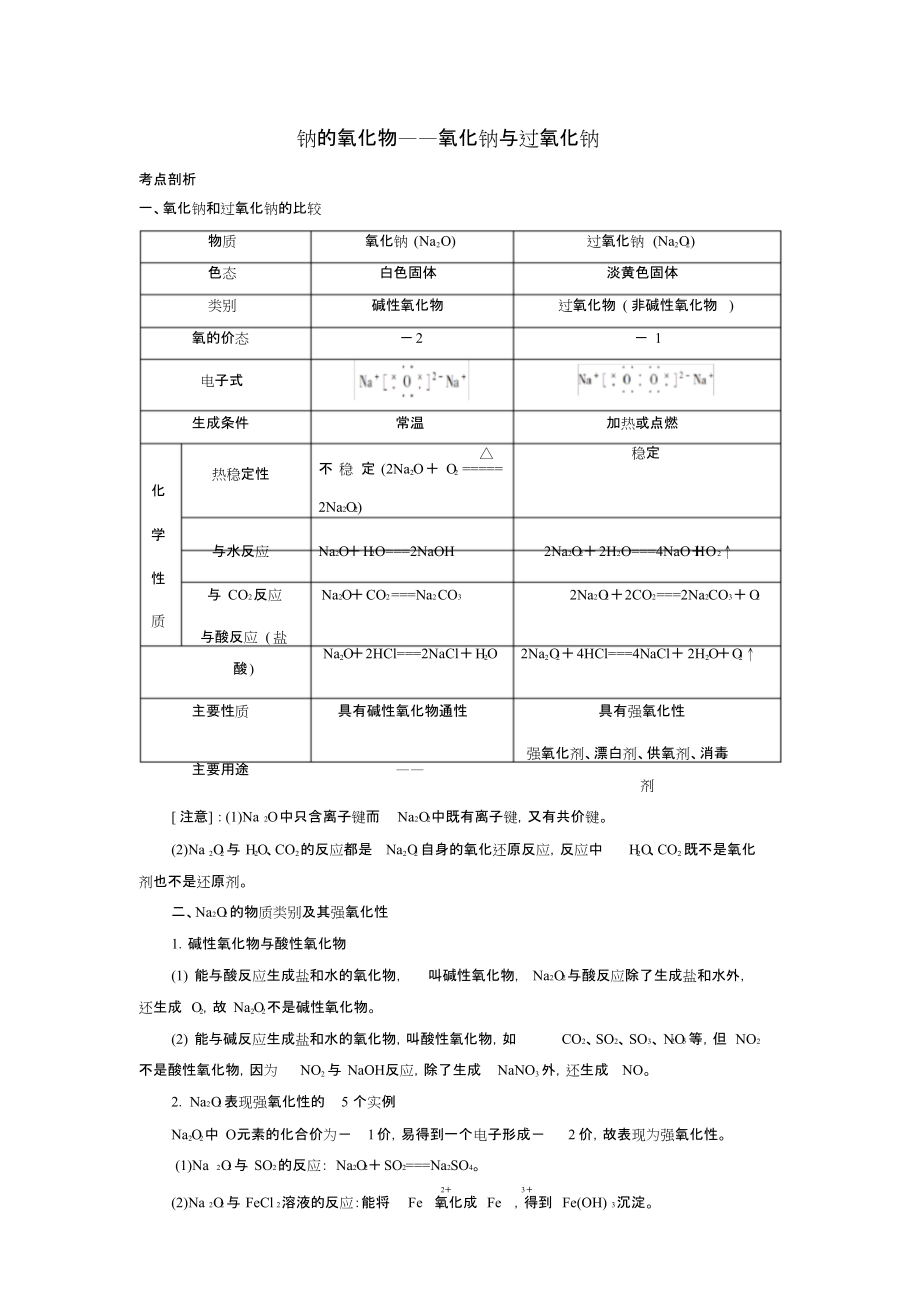
一����、氧化鈉和過氧化鈉的比較
物質(zhì) 氧化鈉 (Na2O) 過氧化鈉 (Na2O2)
色態(tài) 白色固體 淡黃色固體
類別 堿性氧化物 過氧化物 ( 非堿性氧化物 )
氧的價(jià)態(tài) -2 - 1
電子式
生成條件 常溫 加熱或點(diǎn)燃
熱穩(wěn)定性
△
不 穩(wěn) 定 (2Na2O+ O2 =====
穩(wěn)定
化
2Na2O2)
學(xué)
與水反應(yīng) N a2O+H2O===2NaOH 2Na2O2+2 H2O===4NaO+HO2↑
性
與 CO2 反應(yīng) N a2O+C O2 ===Na2 C O3 2Na2O2+2CO2===2Na2
2、C O3+O2
質(zhì)
與酸反應(yīng) ( 鹽
Na2O+2HCl===2NaCl+H2O 2Na2O2+4HCl===4NaCl+2 H2O+O2↑
酸)
主要性質(zhì) 具有堿性氧化物通性 具有強(qiáng)氧化性
強(qiáng)氧化劑��、漂白劑�����、供氧劑�、消毒 主要用途 ——
劑
[ 注意] :(1)Na 2O中只含離子鍵而 N a2O2中既有離子鍵,又有共價(jià)鍵�����。
(2)Na 2O2 與 H2O����、C O2 的反應(yīng)都是 N a2O2 自身的氧化還原反應(yīng)���,反應(yīng)中 H2O�����、C O2 既不是氧化
劑也不是還原劑�����。
二���、Na2O2 的物質(zhì)類別及其強(qiáng)氧化性
1.堿性氧化物與酸性氧化物
(1) 能與酸反應(yīng)生成鹽和水的氧
3����、化物��, 叫堿性氧化物�, Na2O2 與酸反應(yīng)除了生成鹽和水外,
還生成 O2�����,故 Na2O2 不是堿性氧化物�。
(2) 能與堿反應(yīng)生成鹽和水的氧化物,叫酸性氧化物���,如 C O2�、S O2、SO3��、N2O5 等�����,但 N O2
不是酸性氧化物�����,因?yàn)?N O2 與 NaOH反應(yīng)�����,除了生成 NaNO3 外���,還生成 N O����。
2.Na2O2 表現(xiàn)強(qiáng)氧化性的 5 個(gè)實(shí)例
Na2O2 中 O元素的化合價(jià)為- 1 價(jià)�,易得到一個(gè)電子形成- 2 價(jià)���,故表現(xiàn)為強(qiáng)氧化性��。
(1)Na 2O2 與 SO2 的反應(yīng): N a2O2+S O2===Na2SO4���。
2+ 3+
(2)Na 2O2 與 FeC
4��、l 2 溶液的反應(yīng):能將 Fe 氧化成 Fe ��,得到 Fe(OH) 3 沉淀��。
(3)Na 2O2 與 H2S 的反應(yīng):能將 H2S氧化成單質(zhì)S����。
2- 2- (4)Na 2O2 與 N a2SO3 溶液的反應(yīng):能將 SO3 氧化成 SO4 ���。
(5)Na 2O2 與品紅溶液的反應(yīng):能使品紅溶液褪色���;與酚酞溶液反應(yīng):能使酚酞先變紅、
后褪色����。
考向分析:
考向一:過氧化鈉的多重性質(zhì)表現(xiàn)
典例 1、過氧化鈉具有強(qiáng)氧化性���,遇木炭�����、鋁粉等還原性物質(zhì)時(shí)可燃燒�。下列有關(guān)說法
不正確的是 ( )
A.Na2O2 與 C O2 反應(yīng)時(shí), Na2O2 是氧化劑��, C O2 是還原劑
B.1
5�����、 mol過氧化鈉中陰離子數(shù)目為NA
C.過氧化鈉與木炭����、鋁粉反應(yīng)時(shí),過氧化鈉均表現(xiàn)出強(qiáng)氧化性
D.過氧化鈉與二氧化硫反應(yīng)時(shí)可生成硫酸鈉
解析:選A Na 2O2 與 C O2 反應(yīng)生成 N a2C O3 和 O2��,反應(yīng)中 Na2O2 既是氧化劑也是還原劑���, A
錯(cuò)誤���; Na2O2 的電子式為Na + [ O O ]
+ [ O O ]
2-N a+,1 mol Na 2O2 中陰離子數(shù)目為NA�����,B正確���; Na2O2
2O2 中陰離子數(shù)目為NA�����,B正確�����; Na2O2
具有強(qiáng)氧化性����,鋁���、木炭具有還原性����, C 正確����; N a2O2 具有氧化性���, SO2 具有還原性, Na2O2
6��、與
SO2 反應(yīng)時(shí)可生成硫酸鈉Na2O2+SO2===Na2S O4����,D正確。
指導(dǎo): Na2O2結(jié)構(gòu)和強(qiáng)氧化性的?�?键c(diǎn)
(1)Na2O2 的電子式為Na 2 是個(gè)原子團(tuán)�,是一個(gè)整體。
+ ��,O2-
(2)Na2O2 與 H2O�����、C O2 的反應(yīng)都是 N a2O2 自身的氧化還原反應(yīng)����,在反應(yīng)中 H2O、 C O2 既不是
氧化劑�,也不是還原劑。
(3)在研究 N a2O2 與其他溶液反應(yīng)時(shí),要注意 Na2O2 的強(qiáng)氧化性和其溶液的強(qiáng)堿性�。熟記
Na2O2 表現(xiàn)強(qiáng)氧化性的 5 個(gè)實(shí)例:
①Na2O2 與 SO2 的反應(yīng): N a2O2+ SO2===Na2SO4。
②Na2O
7�、2 與 FeCl2 溶液的反應(yīng):能將 Fe
2 +氧化成 Fe3+,得到 Fe(OH)
3 沉淀�。
③Na2O2 與氫硫酸的反應(yīng):能將 H2S 氧化成單質(zhì)硫�����。
2- 2-
④N a2O2 與 N a2SO3 溶液的反應(yīng):能將 SO3 氧化成 SO
4 �。
⑤Na2O2 與品紅溶液的反應(yīng):能使品紅溶液褪色。
考向二:關(guān)于 N a2O2 性質(zhì)的綜合探究
典例 2.在密閉容器中充入 C O2�、C O、C H4 的混合氣體共 mg�,若加入足量 Na2O2,充分振
蕩并不斷用電火花引燃至反應(yīng)完全�,測(cè)得固體質(zhì)量增加 mg ,則C O2 與 C H4 的體積比為( )
A.3∶ 1 B
8�����、 .2∶ 1
C.1∶ 1 D .任意比
2
點(diǎn)燃
解析:選C 2CO+O2=====2CO2①
2Na2O2+ 2CO2 ===2Na2C O3+O2②
①+②得: Na2O2+CO===N2aC O3( 虛擬的反應(yīng))
即: CO可被 N a2O2 完全吸收
點(diǎn)燃
2 H2+O2=====2H2O③
2Na2O2+ 2H2O===4NaO+HO2↑④
③+④得: Na2O2+H2===2NaOH虛(擬的反應(yīng))
即: H2 可被 Na2O2 完全吸收
由于 CO完全被吸收����,當(dāng) C O2、C H4 的體積比符合 1∶ 1時(shí),相當(dāng)于 2CO∶ 2H2�,可被 Na2O2
9、完全吸收�����。
指導(dǎo): Na2O2 與 C O2 和 H2O反應(yīng)的五大關(guān)系
(1)物質(zhì)的量的關(guān)系
無論是 CO2 或 H2O的單一物質(zhì)還是二者的混合物����, 通過足量的 Na2O2時(shí),C O2 或 H2O與放出
O2 的物質(zhì)的量之比均為2∶ 1����。
(2)氣體體積關(guān)系
若 CO2 和水蒸氣的混合氣體 ( 或單一氣體 ) 通過足量 Na2O2,氣體體積的減少量為原混合氣
體體積的
1
���,即為生成氧氣的量�����。
2
(3)固體質(zhì)量關(guān)系
相當(dāng)于固體 N a2O2 只吸收了 C O2 中的“ C O”�,H2O 中的“ H2”�����;可以看做發(fā)生相應(yīng)的反應(yīng):
Na2 O2 +CO===N2aC
10、 O3�����, N a2O2+H2===2NaOH實(shí)(際上兩反應(yīng)都不容易直接發(fā)生 ) �。
(4)電子轉(zhuǎn)移關(guān)系
當(dāng) Na2O2 與 C O2、H2O反應(yīng)時(shí)��,每產(chǎn)生 1 mol O 2轉(zhuǎn)移 2 mol e
-�。
如:
(5)先后順序關(guān)系
一定量的 N a2O2 與一定量的 C O2 和 H2O(g) 的混合物的反應(yīng),可看做 Na2O2 先與 C O2 反應(yīng)�����,
待 CO2 反應(yīng)完全后��, N a2O2 再與 H2O(g)發(fā)生反應(yīng)�。
對(duì)點(diǎn)訓(xùn)練
1.將含有 O2 和 C H4 的混合氣體置于盛有 23.4g Na2O2 的密閉容器中��,電火花點(diǎn)燃�,反應(yīng)結(jié)
束后,容器內(nèi)的壓強(qiáng)為零 (15
11�、0 ℃) ,將殘留物溶于水中����,無氣體產(chǎn)生.下列敘述正確的
是( )
3
A.原混合氣體中 O2 和 C H4 的體積比為 2:1
B.殘留物只有 N a2C O3
C.原混合氣體中 O2 與 C H4 的體積比為 1:1
D.殘留物只有 N a2C O3 和 NaOH
【答案】 D
【解析】 A.根據(jù)上述分析得到的反應(yīng)可知�����, O2 和 C H4 按照 1:2 恰好與 0���,3mol 過氧化鈉反
應(yīng),無氣體剩余���, 原混合氣體中 O2和 C H4 的體積比為 2:1 時(shí)�����,剩余甲烷�����, 故 A 錯(cuò)誤�;B.甲
烷燃燒生成的氣體有二氧化碳和水蒸氣�,所以和過氧化鈉反應(yīng)時(shí)殘留物有 Na2C
12、O3 和
NaOH���,故 B 錯(cuò)誤�; C.根據(jù)上述分析得到的反應(yīng)可知, O2 和 C H4 按照 1:2 恰好與 0.3mol
過氧化鈉反應(yīng)�����,原混合氣體中 O2 與 CH4 的體積比為 1:1�,剩余氧氣,故 C 錯(cuò)誤����; D.由
題意結(jié)合分析得到的反應(yīng)關(guān)系可知,殘留物只有 Na2C O3 和 NaOH��,故 D正確�����;故選 D�����。
2+ 3+
2.在含有 Fe �����、Fe ���、Al
3+
+
�、N H4 的溶液中加入足量的 Na2O2 固體�, 再加入過量的稀鹽酸,
完全反應(yīng)后�,離子數(shù)目幾乎沒有改變的是 ( )
2+ B .Fe3+ A.Fe
C.Al
3+ D .NH
13、
+
4
【答案】 C
解析: Fe
2+ 3+ 2+ 3+
被 N a2O2 氧化成 Fe �,F(xiàn)e 數(shù)目減少, Fe
+
數(shù)目增多����; NH4 與 NaOH(由
+
Na2 O2 與水反應(yīng)生成 ) 反應(yīng)放出氨氣, NH4 數(shù)目減少���; Al
3+
發(fā)生如下變化: Al
3+ -
→Al(OH) 3→AlO
2
→Al
3+����,Al 3+數(shù)目幾乎沒有改變��。
3.為了使宇航員在飛船中得到一個(gè)穩(wěn)定的�����、良好的生存環(huán)境��,一般在飛船內(nèi)安裝盛有 Na2O2
或 K2O2 顆粒的裝置,它的用途是產(chǎn)生氧氣.下列關(guān)于 Na2O2 的敘述正確的是 ( )
A
14�、.Na2O2 中陰、陽(yáng)離子的個(gè)數(shù)比為 1:2
B.Na2O2 分別與水及 C O2 反應(yīng)產(chǎn)生相同量的 O2 時(shí)����,需要水和 C O2 的質(zhì)量相等
C.Na2O2 與 N a2O均是堿性氧化物
D.Na2O2 能漂白所有有色物質(zhì)
【答案】 A
【解析】 A.Na2O2 的電子式為 ,故陰���、陽(yáng)離子的個(gè)數(shù)比為 1:2���,故 A正確;
B.根據(jù) 2Na2O2+2CO2=2Na2C O3+ O2����,2Na2O2+2H2O=4NaOH+2O↑,可知生成相同量的 O2 時(shí)消耗
的水和二氧化碳的物質(zhì)的量相同��, 但質(zhì)量不同���, 故 B錯(cuò)誤;C.Na2O為堿性氧化物�, Na2O2
能和鹽酸反應(yīng)生成氯化鈉和
15、水和氧氣��, 為過氧化物, 不是堿性氧化物���, 故 C錯(cuò)誤�;D.過
4
氧化鈉具有漂白性原理是將有色物質(zhì)氧化成無色物質(zhì)�, 常用于織物、 絲稠�����、麥稈等漂白����,
但不能漂白所有有色物質(zhì),故 D錯(cuò)誤��;故選 A�����。
4.一定溫度下����, m g 某物質(zhì) A 在足量氧氣中充分燃燒,使燃燒產(chǎn)物跟足量過氧化鈉反應(yīng)�����,
過氧化鈉質(zhì)量增加了 n g ,且 n=m�����,符合此要求的物質(zhì)可能是 ( )
①H2 ②CO ③H2 和 CO的混合物 ④HCOOC3 H ⑤C H3CHO
A.⑤ B .只有①② C .④⑤ D .①②③④
【答案】 D
5.下列物質(zhì)均有漂白作用��,其漂白原理相同的是 ( )
①過氧化鈉 ②
16�、次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧
A.①②⑤ B .①③⑤ C .②③④ D .①②③
【答案】 A
【解析】①過氧化鈉、②次氯酸��、⑤臭氧均具有強(qiáng)氧化性�,屬于氧化型漂白,③二氧化
硫?qū)儆诨闲推祝?
④活性炭屬于吸附型漂白����,故選 A。
6�����、如圖所示����,兩圓圈相交的陰影部分表示圓圈內(nèi)物質(zhì)相互發(fā)生的反應(yīng)。鈉及其氧化物的物
質(zhì)的量均為 0.1 mol ��,水的質(zhì)量為 100 g ����。
(1) 反應(yīng)③的化學(xué)方程式為 __________________________________ ,0.1 mol Na 2O2 與水
反應(yīng)轉(zhuǎn)移電子數(shù)目為 ________����。
(2) 反應(yīng)③最多產(chǎn)生 O2 的物質(zhì)的量為 ________mol。
(3) ①�、②、③充分反應(yīng)后��,所得溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)由大到小的順序是 ________�����。
答案: (1)2Na 2O2+2H2O===4NaO+H O2↑ 0.1 NA
(2)0.05
(3) ③=②>①
5
 2019版高考化學(xué)總復(fù)習(xí)專題鈉的氧化物——氧化鈉與過氧化鈉導(dǎo)學(xué)案
2019版高考化學(xué)總復(fù)習(xí)專題鈉的氧化物——氧化鈉與過氧化鈉導(dǎo)學(xué)案