《2022年高考化學(xué)命題熱點提分攻略 專題03 化學(xué)計量的相關(guān)應(yīng)用難點突破學(xué)案》由會員分享�����,可在線閱讀��,更多相關(guān)《2022年高考化學(xué)命題熱點提分攻略 專題03 化學(xué)計量的相關(guān)應(yīng)用難點突破學(xué)案(6頁珍藏版)》請在裝配圖網(wǎng)上搜索��。
1���、2022年高考化學(xué)命題熱點提分攻略 專題03 化學(xué)計量的相關(guān)應(yīng)用難點突破學(xué)案
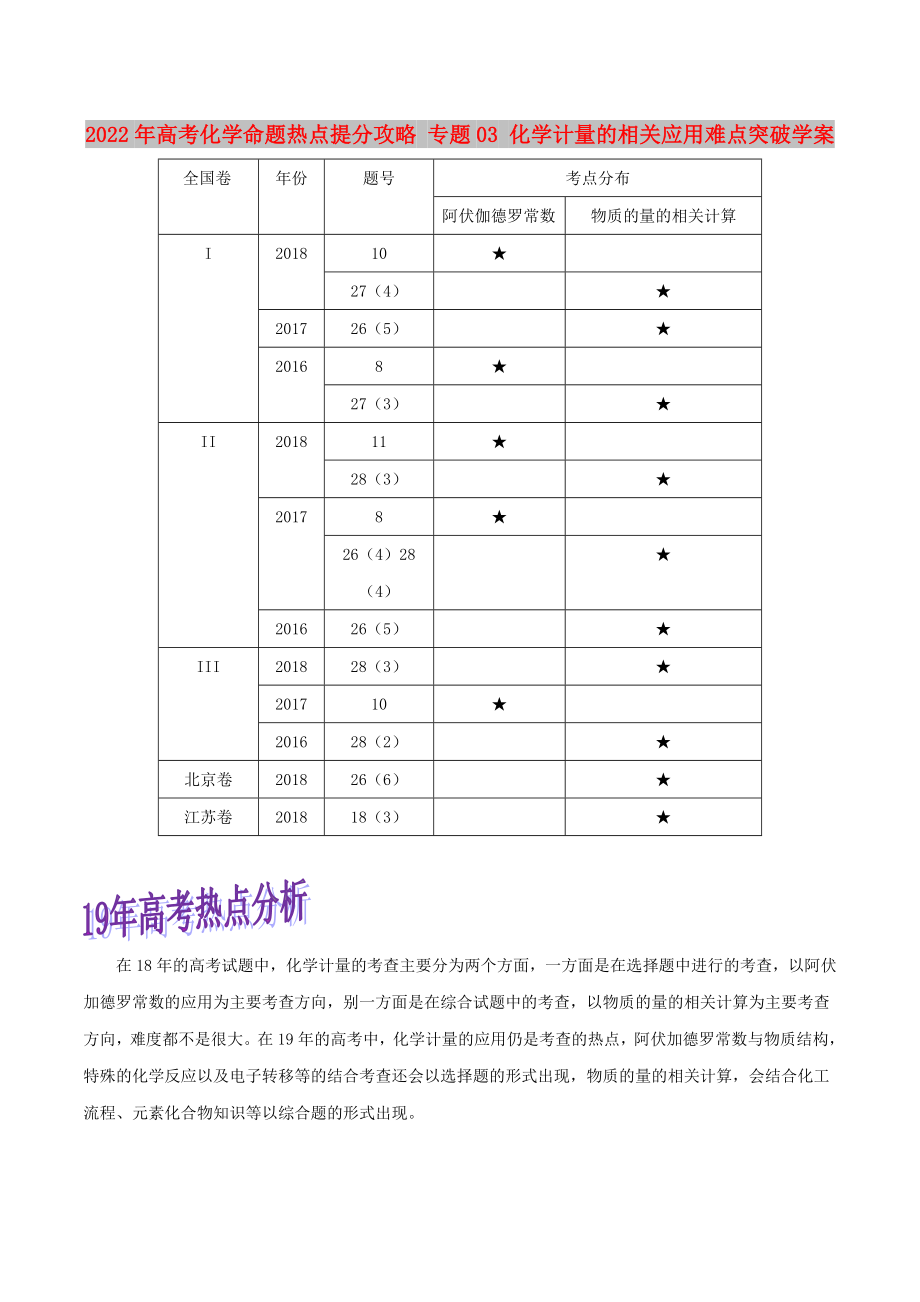
全國卷
年份
題號
考點分布
阿伏伽德羅常數(shù)
物質(zhì)的量的相關(guān)計算
I
2018
10
★
27(4)
★
2017
26(5)
★
2016
8
★
27(3)
★
II
2018
11
★
28(3)
★
2017
8
★
26(4)28(4)
★
2016
26(5)
★
III
2018
28(3)
★
2017
10
★
2016
28(2)
★
北京卷
2018
2�����、26(6)
★
江蘇卷
2018
18(3)
★
在18年的高考試題中�����,化學(xué)計量的考查主要分為兩個方面��,一方面是在選擇題中進(jìn)行的考查�,以阿伏加德羅常數(shù)的應(yīng)用為主要考查方向,別一方面是在綜合試題中的考查�,以物質(zhì)的量的相關(guān)計算為主要考查方向,難度都不是很大�。在19年的高考中,化學(xué)計量的應(yīng)用仍是考查的熱點��,阿伏加德羅常數(shù)與物質(zhì)結(jié)構(gòu)���,特殊的化學(xué)反應(yīng)以及電子轉(zhuǎn)移等的結(jié)合考查還會以選擇題的形式出現(xiàn),物質(zhì)的量的相關(guān)計算��,會結(jié)合化工流程�����、元素化合物知識等以綜合題的形式出現(xiàn)。
考點一 阿伏伽德羅常數(shù)
1.牢記兩大常數(shù):
(1)阿伏加德羅常數(shù):6.02×1023mol-1����。
3、(2)氣體摩爾體積(標(biāo)準(zhǔn)狀況):22.4 L·mol-1����。
2.理解兩大規(guī)律:
(1)質(zhì)量守恒定律。
①化學(xué)反應(yīng)前后���,反應(yīng)物和生成物的質(zhì)量相等�。
②稀釋前后�,溶質(zhì)的質(zhì)量(或物質(zhì)的量)不變。
(2)電荷守恒規(guī)律��。
溶液中陽離子所帶的正電荷總數(shù)等于陰離子所帶的負(fù)電荷總數(shù)���。
3.牢記六個基本公式:(1) (2) (3) (4) (5) (6) (或 )
【典例1】【2018全國1】NA是阿伏加德羅常數(shù)的值���,下列說法正確的是
A. 16.25 g FeCl3水解形成的Fe(OH)3膠體粒子數(shù)為0.1 NA
B. 22.4 L(標(biāo)準(zhǔn)狀況)氬氣含有的質(zhì)子數(shù)為18NA
C. 92.0
4、g甘油(丙三醇)中含有羥基數(shù)為1.0NA
D. 1.0 mol CH4與Cl2在光照下反應(yīng)生成的CH3Cl分子數(shù)為1.0NA
【答案】B
D錯誤�。答案選B�����。
點睛:選項D是易錯點�,主要是不清楚甲烷發(fā)生取代反應(yīng)時屬于自由基取代反應(yīng)���,每個氫原子都有可能被取代����,其產(chǎn)物比較復(fù)雜��,這與乙烯與氫氣的加成反應(yīng)完全不同��。
【典例2】【2018全國2】NA代表阿伏加德羅常數(shù)的值����。下列說法正確的是
A. 常溫常壓下,124 g P4中所含P—P鍵數(shù)目為4NA
B. 100 mL 1mol·L?1FeCl3溶液中所含F(xiàn)e3+的數(shù)目為0.1NA
C. 標(biāo)準(zhǔn)狀況下���,11.2 L甲烷和乙烯混合物中含氫原
5��、子數(shù)目為2NA
D. 密閉容器中�,2 mol SO2和1 mol O2催化反應(yīng)后分子總數(shù)為2NA
【答案】C
考點二 物質(zhì)的量的相關(guān)計算
物質(zhì)的量濃度計算的兩個關(guān)鍵
(1)正確判斷溶液的溶質(zhì)并求其物質(zhì)的量���。
①與水發(fā)生反應(yīng)生成新的物質(zhì)�����,如Na�����、Na2O�����、Na2O2 NaOH�����,SO3 H2SO4等��。
②含結(jié)晶水的物質(zhì)���,如CuSO4·5H2O→CuSO4。
③特殊物質(zhì)��,如NH3溶于水后大部分結(jié)合為NH3·H2O�����,但計算濃度時仍以NH3分子作為溶質(zhì)。
(2)準(zhǔn)確計算溶液的體積��。
①不能用水的體積代替溶液體積���,應(yīng)根據(jù)V= 求算�����。
②溶液發(fā)生化學(xué)反應(yīng)后��,應(yīng)根據(jù)化學(xué)方
6����、程式判斷溶質(zhì)物質(zhì)的量的增加或減少�,并注意溶液體積變化和各種守恒關(guān)系的應(yīng)用。
【典例3】【2018全國1】焦亞硫酸鈉(Na2S2O5)在醫(yī)藥�����、橡膠�、印染、食品等方面應(yīng)用廣泛���?��;卮鹣铝袉栴}:
(4)Na2S2O5可用作食品的抗氧化劑。在測定某葡萄酒中Na2S2O5殘留量時�����,取50.00 mL葡萄酒樣品���,用0.01000 mol·L?1的碘標(biāo)準(zhǔn)液滴定至終點����,消耗10.00 mL�。滴定反應(yīng)的離子方程式為_____________,該樣品中Na2S2O5的殘留量為____________g·L?1(以SO2計)���。
【答案】S2O52-+2I2+3H2O=2SO42-+4I-+6H+ 0.128
7���、
【解析】(4)單質(zhì)碘具有氧化性,能把焦亞硫酸鈉氧化為硫酸鈉����,反應(yīng)的方程式為S2O52-+2I2+3H2O=2SO42-+4I-+6H+���;消耗碘的物質(zhì)的量是0.0001mol,所以焦亞硫酸鈉的殘留量(以SO2計)是�。
【典例4】【2018全國2】K3[Fe(C2O4)3]·3H2O(三草酸合鐵酸鉀)為亮綠色晶體,可用于曬制藍(lán)圖���?;卮鹣铝袉栴}:
(3)測定三草酸合鐵酸鉀中鐵的含量�。
①稱量m g樣品于錐形瓶中,溶解后加稀H2SO4酸化���,用c mol·L-1 KMnO4溶液滴定至終點�����。滴定終點的現(xiàn)象是___________________________���。
②向上述溶液中加入過量鋅粉至
8、反應(yīng)完全后�,過濾、洗滌��,將濾液及洗滌液全部收集到錐形瓶中。加稀H2SO4酸化���,用c mol·L-1 KMnO4溶液滴定至終點���,消耗KMnO4溶液V mL。該晶體中鐵的質(zhì)量分?jǐn)?shù)的表達(dá)式為________________________________�。
【答案】粉紅色出現(xiàn)
【典例5】【2018北京卷】磷精礦濕法制備磷酸的一種工藝流程如下:
已知:磷精礦主要成分為Ca5(PO4)3(OH),還含有Ca5(PO4)3F和有機碳等�。
溶解度:Ca5(PO4)3(OH)
9、H溶液滴定至終點時生成Na2HPO4���,消耗NaOH溶液c mL����,精制磷酸中H3PO4的質(zhì)量分?jǐn)?shù)是________�����。(已知:H3PO4摩爾質(zhì)量為98 g·mol?1)
【答案】
【解析】(6)滴定終點生成Na2HPO4,則消耗的H3PO4與NaOH物質(zhì)的量之比為1:2��,n(H3PO4)=n(NaOH)=bmol/Lc10-3L=mol�����,m(H3PO4)=mol98g/mol=g=0.049bcg����,精制磷酸中H3PO4的質(zhì)量分?jǐn)?shù)為。
【典例6】【2018江蘇卷】堿式硫酸鋁溶液可用于煙氣脫硫���。室溫下向一定濃度的硫酸鋁溶液中加入一定量的碳酸鈣粉末����,反應(yīng)后經(jīng)過濾得到堿式硫酸鋁溶液���,反應(yīng)方程式為
10�、
(2?x)Al2(SO4)3+3xCaCO3+3xH2O2[(1?x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1?x)Al2(SO4) 3·xAl(OH)3中x值的大小影響堿式硫酸鋁溶液的脫硫效率���。
(3)通過測定堿式硫酸鋁溶液中相關(guān)離子的濃度確定x的值�,測定方法如下:
①取堿式硫酸鋁溶液25.00 mL��,加入鹽酸酸化的過量BaCl2溶液充分反應(yīng),靜置后過濾�、洗滌,干燥至恒重��,得固體2.3300 g����。
②取堿式硫酸鋁溶液2.50 mL,稀釋至25 mL���,加入0.1000 mol·L?1EDTA標(biāo)準(zhǔn)溶液25.00 mL�,調(diào)節(jié)溶液pH約為4.2��,煮
11�、沸���,冷卻后用0.08000 mol·L?1CuSO4標(biāo)準(zhǔn)溶液滴定過量的EDTA至終點���,消耗CuSO4標(biāo)準(zhǔn)溶液20.00 mL(已知Al3+、Cu2+與EDTA反應(yīng)的化學(xué)計量比均為1∶1)�。
計算(1?x)Al2(SO4)3·xAl(OH)3中的x值(寫出計算過程)。
【答案】(3)25mL溶液中:n(SO42?)= n(BaSO4) ==0.0100 mol
2.5 mL溶液中:
n(Al3+) = n(EDTA)?n(Cu2+)=0.1000mol·L?1×25.00 mL×10?3L·mL?1?0.08000 mol·L?1×20.00 mL
×10?3 L·mL?1=9.000×10?4 mol
25 mL溶液中:n(Al3+)=9.000×10?3 mol
1 mol (1?x)Al2(SO4)3·xAl(OH)3中
n(Al3+)=(2?x)mol�;n(SO42?)=3(1?x)mol
==,解得x=0.41
 2022年高考化學(xué)命題熱點提分攻略 專題03 化學(xué)計量的相關(guān)應(yīng)用難點突破學(xué)案
2022年高考化學(xué)命題熱點提分攻略 專題03 化學(xué)計量的相關(guān)應(yīng)用難點突破學(xué)案