《2022年高中化學(xué) 物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用學(xué)案 新人教版必修1》由會(huì)員分享�����,可在線閱讀�,更多相關(guān)《2022年高中化學(xué) 物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用學(xué)案 新人教版必修1(5頁珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索����。
1、2022年高中化學(xué) 物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用學(xué)案 新人教版必修1
【學(xué)習(xí)目標(biāo)】
1.能應(yīng)用物質(zhì)的量進(jìn)行簡(jiǎn)單的化學(xué)計(jì)算����。
2.知道物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用計(jì)算的格式規(guī)范。
3.體會(huì)定量研究的方法對(duì)研究和學(xué)習(xí)化學(xué)的重要作用����。
【活動(dòng)過程】
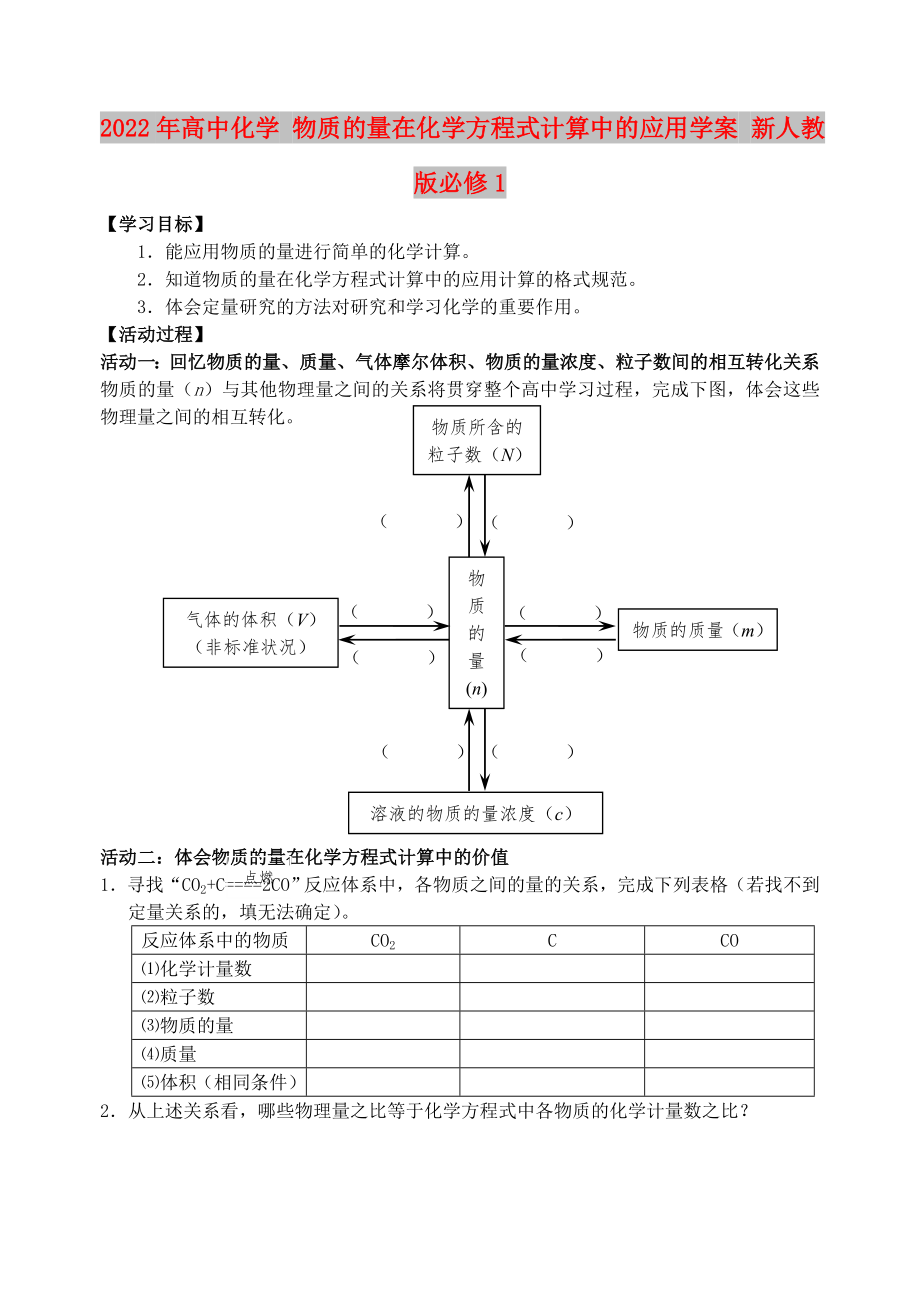
活動(dòng)一:回憶物質(zhì)的量、質(zhì)量����、氣體摩爾體積����、物質(zhì)的量濃度���、粒子數(shù)間的相互轉(zhuǎn)化關(guān)系
物質(zhì)所含的粒子數(shù)(N)
物質(zhì)的量(n)
氣體的體積(V)(非標(biāo)準(zhǔn)狀況)
物質(zhì)的質(zhì)量(m)
溶液的物質(zhì)的量濃度(c)
( )
( )
( )
( )
( )
( )
2�����、
( )
( )
物質(zhì)的量(n)與其他物理量之間的關(guān)系將貫穿整個(gè)高中學(xué)習(xí)過程���,完成下圖,體會(huì)這些物理量之間的相互轉(zhuǎn)化�����。
點(diǎn)燃
活動(dòng)二:體會(huì)物質(zhì)的量在化學(xué)方程式計(jì)算中的價(jià)值
1.尋找“CO2+C====2CO”反應(yīng)體系中�����,各物質(zhì)之間的量的關(guān)系���,完成下列表格(若找不到定量關(guān)系的����,填無法確定)。
反應(yīng)體系中的物質(zhì)
CO2
C
CO
⑴化學(xué)計(jì)量數(shù)
⑵粒子數(shù)
⑶物質(zhì)的量
⑷質(zhì)量
⑸體積(相同條件)
2.從上述關(guān)系看�,哪些物理量之比
3、等于化學(xué)方程式中各物質(zhì)的化學(xué)計(jì)量數(shù)之比����?
活動(dòng)三:參考教材中的解題格式,解決下列有關(guān)計(jì)算問題
1.將50gCaCO3與足量鹽酸反應(yīng)���,理論上消耗鹽酸的物質(zhì)的量是多少�?在標(biāo)準(zhǔn)狀況下得到CO2的體積是多少��?
2.過氧化鈉能與水發(fā)生反應(yīng):2Na2O2+2H2O==4NaOH+O2↑���,該反應(yīng)也可用于實(shí)驗(yàn)室制取氧氣。某同學(xué)用該反應(yīng)制取標(biāo)注狀況下1.12L氧氣��。
⑴計(jì)算至少需要稱取過氧化鈉的質(zhì)量�����。
⑵若反應(yīng)所得氫氧化鈉溶液的體積是200mL���,計(jì)算該溶液中溶質(zhì)的物質(zhì)的濃度����。
4、
【課堂反饋】
1.下列金屬在適當(dāng)條件下與水作用均能生成氣體�����。當(dāng)它們分別與足量水作用消耗等物質(zhì)的量的下列物質(zhì)時(shí)����,生成氣體在標(biāo)準(zhǔn)狀況下所占體積最大的是
A.鈉 B.鉀 C.鎂 D.鐵
2.鋁分別與足量的稀鹽酸和氫氧化鈉溶液反應(yīng),當(dāng)兩個(gè)反應(yīng)所生成的氣體在標(biāo)準(zhǔn)狀況下體積相等時(shí)�,反應(yīng)中消耗的鋁的物質(zhì)的量之比是
A.3∶1 B.2∶1 C.1∶1 D.1∶3
3.鋁分別與足量的稀鹽酸和氫氧化鈉溶液反應(yīng),當(dāng)兩個(gè)反應(yīng)所生成的氣體在標(biāo)準(zhǔn)狀況下體積相
5�����、等時(shí)����,反應(yīng)中消耗HCl和NaOH的物質(zhì)的量之比是
A.3∶1 B.2∶1 C.1∶1 D.1∶3
4.把a(bǔ)g鐵鋁合金粉末溶于足量的鹽酸中,加入過量NaOH的溶液(已知?dú)溲趸X可溶于過量的NaOH溶液)���,過濾沉淀��。經(jīng)洗滌����、干燥、灼燒���,得到紅色氧化鐵粉末的質(zhì)量仍為ag����,則原合金中鐵的質(zhì)量分?jǐn)?shù)為
A.70% B.52.4% C.47.6% D.30%
5.甲�、乙兩燒杯中各有盛有100mL、3mol/L的鹽酸和氫氧化鈉溶液�����,向兩燒杯中分別加入等質(zhì)量的鋁粉���,反應(yīng)結(jié)束后測(cè)得生成氣體
6���、的體積比為甲∶乙=1∶2�����,則加入鋁粉的質(zhì)量為
A.5.4g B.3.6g C.2.7g D.1.6g
6.已知常溫下H2的密度是0.0893g/L。某燒杯中加入50.00mL水���,并放入一小塊金屬鈉���,反應(yīng)完全后冷卻,稱量所得溶液質(zhì)量為52.2g�����,體積為50.00mL�����。試求:
⑴加入鈉的質(zhì)量和所得H2在常溫下的體積��;
⑵所得溶液中NaOH的物質(zhì)的量濃度�。
課題2 物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用
【活動(dòng)結(jié)果】
活動(dòng)一:回憶物質(zhì)的量、質(zhì)量�、氣體摩爾
7、體積�、物質(zhì)的量濃度、粒子數(shù)間的相互轉(zhuǎn)化關(guān)系
物質(zhì)所含的粒子數(shù)(N)
物質(zhì)的量(n)
氣體的體積(V)(非標(biāo)準(zhǔn)狀況)
物質(zhì)的質(zhì)量(m)
溶液的物質(zhì)的量濃度(c)
( )
( )
( )
( )
( )
( )
( )
( )
÷NA
×NA
×M
÷Vm
÷M
×Vm
×V液
÷V液
活動(dòng)二:體會(huì)物質(zhì)的量在化學(xué)方程式計(jì)算中的價(jià)值
1.⑴1 1 2 ⑵1 1 2 ⑶1 1 2
8�����、⑷44 12 56 ⑸1 無法確定 2
2.對(duì)應(yīng)物質(zhì)的量之比、物質(zhì)的粒子數(shù)之比��、相同狀況下對(duì)應(yīng)氣體的體積比等于化學(xué)方程式中各物質(zhì)的化學(xué)計(jì)量數(shù)之比��。
活動(dòng)三:參考教材中的解題格式��,解決下列有關(guān)計(jì)算問題
1.CaCO3+2HCl====CaCl2+CO2↑+H2O
100g 2mol 22.4L
50g n(HCl) V(CO2)
解得:n(HCl)=1mol����,V(CO2)=11.2L
答:理論上消耗鹽酸的物質(zhì)的量是1mol;在標(biāo)準(zhǔn)狀況下得到CO2的體積是11.2L�。
2.解:2Na2O2+2H2O===4NaOH
9、+ O2↑
156g 4mol 22.4L
m(Na2O2) n(NaOH) 1.12L
答:至少需要稱取過氧化鈉的質(zhì)量為7.8g�,所得溶液的物質(zhì)的量濃度為1mol/L。
【課堂反饋】
1.D 2.C 3.A 4.A 5.A
6.⑴解:2Na + 2H2O==2NaOH + H2↑
2×23g 2mol 2g
m(Na) n(NaOH) m(H2)
據(jù)題意:
m(Na)+50.00mL×1.0g/L=52.2g+m(H2)
解得:m(Na)=2.30g m(H2)=0.100g
所以V(H2)=0.100g÷0893g/L=1.12L
⑵n(NaOH)=m(Na)/(2×23g)×2mol=0.100mol
c(NaOH)=0.1mol÷0.05000mL=2.00mol/L
 2022年高中化學(xué) 物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用學(xué)案 新人教版必修1
2022年高中化學(xué) 物質(zhì)的量在化學(xué)方程式計(jì)算中的應(yīng)用學(xué)案 新人教版必修1