《江蘇省丹陽市第三中學(xué)九年級化學(xué)全冊 6.2 溶液組成的表示(第4課時)導(dǎo)學(xué)案(無答案)(新版)滬教版》由會員分享��,可在線閱讀��,更多相關(guān)《江蘇省丹陽市第三中學(xué)九年級化學(xué)全冊 6.2 溶液組成的表示(第4課時)導(dǎo)學(xué)案(無答案)(新版)滬教版(3頁珍藏版)》請在裝配圖網(wǎng)上搜索��。
1��、課題:6.2溶液組成的表示(第4課時)
班級 姓名 備課組長簽名
【學(xué)習(xí)目標(biāo)】
掌握根據(jù)化學(xué)方程式進行溶液中溶質(zhì)質(zhì)量分?jǐn)?shù)的有關(guān)計算��。
【課前預(yù)習(xí)】
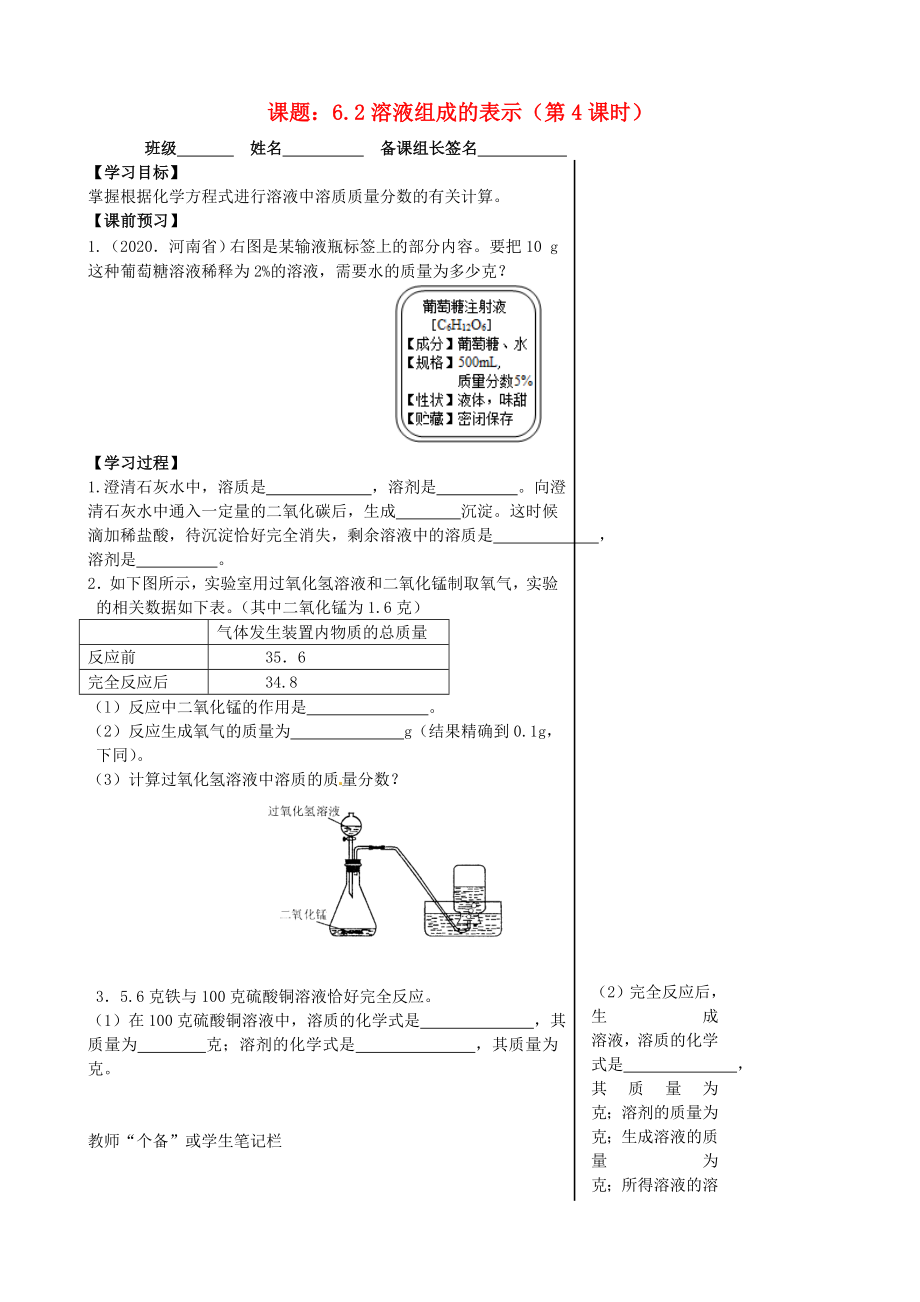
1.(2020.河南?�。┯覉D是某輸液瓶標(biāo)簽上的部分內(nèi)容��。要把10 g這種葡萄糖溶液稀釋為2%的溶液��,需要水的質(zhì)量為多少克��?
【學(xué)習(xí)過程】
1.澄清石灰水中��,溶質(zhì)是 ��,溶劑是 ��。向澄清石灰水中通入一定量的二氧化碳后��,生成 沉淀��。這時候滴加稀鹽酸��,待沉淀恰好完全消失��,剩余溶液中的溶質(zhì)是
2��、 ��,溶劑是 ��。
2.如下圖所示��,實驗室用過氧化氫溶液和二氧化錳制取氧氣��,實驗的相關(guān)數(shù)據(jù)如下表��。(其中二氧化錳為1.6克)
氣體發(fā)生裝置內(nèi)物質(zhì)的總質(zhì)量
反應(yīng)前
35.6
完全反應(yīng)后
34.8
(l)反應(yīng)中二氧化錳的作用是 ��。
(2)反應(yīng)生成氧氣的質(zhì)量為 g(結(jié)果精確到0.1g,下同)��。
(3)計算過氧化氫溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)��?
3.5.6克鐵與100克硫酸銅溶液恰好完全反應(yīng)��。
(1)在100克硫酸銅溶液中��,溶質(zhì)的化學(xué)式是
3��、 ��,其質(zhì)量為 克��;溶劑的化學(xué)式是 ��,其質(zhì)量為 克��。
教師“個備”或?qū)W生筆記欄
(2)完全反應(yīng)后��,生成 溶液��,溶質(zhì)的化學(xué)式是 ��,其質(zhì)量為 克��;溶劑的質(zhì)量為 克��;生成溶液的質(zhì)量為 克��;所得溶液的溶質(zhì)的質(zhì)量分?jǐn)?shù)為 ��。
4.某課外興趣小
4��、組對一批鐵樣品(含有雜質(zhì)��,雜質(zhì)不溶于水��,也不與稀硫酸反應(yīng))進行分析��,甲��、乙��、丙三位同學(xué)分別進行實驗��,其中只有一位同學(xué)所取用的稀硫酸與鐵樣品恰好完全反應(yīng)��。實驗數(shù)據(jù)如下表:
甲
乙
丙
燒杯+稀硫酸
200g
150g
150g
加入的鐵樣品
9g
9g
14g
充分反應(yīng)后��,燒杯+剩余物
208.7g
158.7g
163.7g
請你認(rèn)真分析數(shù)據(jù),回答下列問題:
(1)哪位同學(xué)所取用的稀硫酸與鐵樣品恰好完全反應(yīng)��;
(2)計算樣品中鐵的質(zhì)量分?jǐn)?shù)��;
(3)計算恰好完全反應(yīng)后所得溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)��。
(燒杯的質(zhì)量為25.4g��;計算結(jié)果精確到1%)
5��、
教師“個備”或?qū)W生筆記欄
【當(dāng)堂訓(xùn)練】
1.100g稀硫酸恰好跟6.5g鋅恰好完全反應(yīng)��,試計算:
(1)生成氫氣多少克��?
(2)這種硫酸中溶質(zhì)的質(zhì)量分?jǐn)?shù)為多少��?
(3)反應(yīng)后所得溶液的質(zhì)量分?jǐn)?shù)是多少��?
【課后提升】
1.向盛有鐵��、銅的燒杯中加入過量的稀硫酸��,所得溶液中的溶質(zhì)有 ( )
A��、1種 B��、2種 C��、3種 D��、4種
2.質(zhì)量相等的金屬鋅和鐵分別加入質(zhì)量相等��、溶質(zhì)質(zhì)量分?jǐn)?shù)相等的兩份稀硫酸中��,反應(yīng)完畢后金屬均有
6��、剩余��。則反應(yīng)后兩種溶液的質(zhì)量關(guān)系是 ( )
A��、相等 B��、鋅反應(yīng)后的溶液質(zhì)量大
C��、鐵反應(yīng)后的溶液質(zhì)量大 D��、無法比較
*3.酒精(C2H5OH)的某種水溶液��,溶質(zhì)和溶劑中氫原子個數(shù)相等��,則該溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)為 ( )
A.23% B.46% C.55% D.72%
4.為了增強水的導(dǎo)電性��,現(xiàn)采用100g4%氫氧化鈉溶液來進行水的電解實驗。通電一段時間后��,測得氫氧化鈉溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)為5%
7��、��,計算電解掉的水的質(zhì)量是多少克��?產(chǎn)生氫氣質(zhì)量多少克��?
5.已知金屬鈉能與水發(fā)生如下反應(yīng):2Na+2H2O═2NaOH+H2↑��,若把4.6g金屬鈉投入到盛有足量水的燒杯中(如圖)��,充分反應(yīng)后燒杯中剩余溶液質(zhì)量是40g��,請計算:
(1)生成NaOH的質(zhì)量.
(2)反應(yīng)后所得NaOH溶液的溶質(zhì)質(zhì)量分?jǐn)?shù).
6. 某同學(xué)稱取一定質(zhì)量的鐵粉樣品(含有少量不與稀硫酸反應(yīng)的雜質(zhì))��,放入燒杯中��,加入98g稀硫酸��,恰好完全反應(yīng)��,生成氣體的質(zhì)量與反應(yīng)時間的關(guān)系如題19圖所示��,試回答下列問題:
(1)根據(jù)圖像��,恰好完全反應(yīng)時生成氫氣的質(zhì)量是____________g��;
8��、(2)樣品中鐵的質(zhì)量是多少?稀硫酸的溶質(zhì)質(zhì)量分?jǐn)?shù)是多少?(寫出計算過程)
*7. 將12克少量銅屑的鐵粉樣品放在盛有100克稀鹽酸的燒杯中��,恰好完全反應(yīng)后��,燒杯中物質(zhì)的總質(zhì)量為111.6克��。求:
(1)鐵粉樣品中鐵的純度��;
(2)反應(yīng)后所得溶液中溶質(zhì)的質(zhì)量分?jǐn)?shù)��。
8.在燒杯中加入氯化鈉和碳酸氫鈉的固體混合物10.0 g后��,再加入68.9 g稀鹽酸恰好完全反應(yīng)��。反應(yīng)過程用精密儀器測得燒杯連同藥品的總質(zhì)量(m)與反應(yīng)時間(t)的關(guān)系如右圖所示��。燒杯連同藥品的起始總質(zhì)量為165.0 g��。反應(yīng)的方程式為:NaHCO3+HCl==NaCl+H2O+CO2↑
試回答下列問題:
(1)完全反應(yīng)時產(chǎn)生二氧化碳的質(zhì)量為_____g
(2)原混合物中氯化鈉的質(zhì)量��。
**(3)反應(yīng)后所得氯化鈉溶液中溶質(zhì)質(zhì)量分?jǐn)?shù)。
 江蘇省丹陽市第三中學(xué)九年級化學(xué)全冊 6.2 溶液組成的表示(第4課時)導(dǎo)學(xué)案(無答案)(新版)滬教版
江蘇省丹陽市第三中學(xué)九年級化學(xué)全冊 6.2 溶液組成的表示(第4課時)導(dǎo)學(xué)案(無答案)(新版)滬教版