《2018年高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 1.2 電能轉(zhuǎn)化為化學(xué)能——電解 第1課時課件5 魯科版選修4.ppt》由會員分享�,可在線閱讀,更多相關(guān)《2018年高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 1.2 電能轉(zhuǎn)化為化學(xué)能——電解 第1課時課件5 魯科版選修4.ppt(19頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
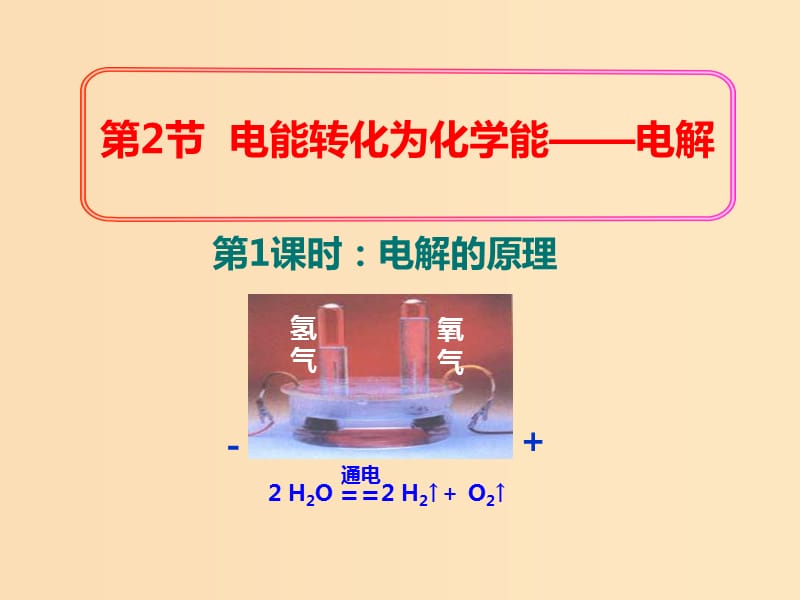
1、第1課時:電解的原理,第2節(jié) 電能轉(zhuǎn)化為化學(xué)能——電解,氫氣,氧氣,-,+,2 H2O 2 H2↑+ O2↑,自從伏打發(fā)明電池后��,“電”的應(yīng)用就風起云涌��,席卷全球�����。英國化學(xué)家戴維就是用電解的方法制出了很活潑的金屬鉀、鈉等��。到了現(xiàn)在�,電解的應(yīng)用就更加廣泛,它用于好多物質(zhì)的制備�����、電鍍���、和電解水等�?��?墒?,你知道電解的原理嗎���?你知道電解工業(yè)的發(fā)展狀況嗎��?你知道……�?讓我們共同走進電解這奇妙的世界吧�����!,1�、以電解氯化銅溶液為例,理解并掌握電解池的概念和構(gòu)成條件���。 2���、掌握電解原理。 3�、掌握電解池的陰極、陽極的電極反應(yīng)式的書寫����。,【活動探究1】探究CuCl2溶液的電解過程,,,,實驗指導(dǎo): 1.按圖示
2、進行實驗操作����。 2.觀察:丙中兩個電極上有什么現(xiàn)象?,電子從陽極流入電源正極�,從電源負極流入電解池陰極。,陰極,陽極,【活動探究1】探究CuCl2溶液的電解過程,陽離子向陰極移動���,陰離子向陽極移動��。,,在直流電作用下����,電解質(zhì)在兩個電極上分別發(fā)生氧化反應(yīng)和還原反應(yīng)的過程叫做電解。,一�、電解的原理,2、電解池,把電能轉(zhuǎn)化為化學(xué)能的裝置��。,1�、電解的概念,3、電極,陽極:,,與外電源正極相連�����,失電子���,氧化反應(yīng)��。,陰極:,與外電源負極相連����,得電子����,還原反應(yīng)��。,,惰性電極:,C�、Pt����、Au等,不論做陰極���、陽極, 本身都不反應(yīng)����。,活性電極:,大部分金屬電極(除Pt、Au) 做陰極本身不反應(yīng)�����; 做陽極����,本身
3、被氧化溶解����。,電極材料,CuCl2溶液,4、構(gòu)成電解池的條件,外加直流電源 與電源相連的兩個電極 電解質(zhì)溶液或熔融電解質(zhì) 閉合回路,CuCl2溶液中有四種離子Cu2+、H+����、Cl-、OH-���,電解過程中為什么是Cu2+和Cl-先反應(yīng)���,而不是H+ 和OH-?,要判斷電極反應(yīng)的產(chǎn)物��,必須掌握離子的放電順序����。,陰極:,陽極:,二、陰�����、陽離子放電的一般順序,陽離子,—— 氧化性強的先得電子,陰離子,—— 還原性強的先失電子,①若金屬(除Pt�、Au)作電極:電極本身放電 ②若為惰性電極:溶液中的陰離子放電,S 2->I ->Br ->Cl ->OH ->SO42-(等含氧酸根離子),無論是惰性電極還是活性
4、電極均為溶液中的陽離子放電,Ag+ > Hg2+ >Fe3+ >Cu2+ >H+ >Pb2+ >Sn2+ >Fe2+ >Zn2+( >H+)>Al3+ >Mg2+ >Na+ >Ca2+ >K+,陽離子:,書寫電解反應(yīng)式的一般思路:,三����、電極反應(yīng)式的書寫,(1)必須標明“通電”條件�����。 (2)若H+或OH-放電���,電極方程式中寫成離子形式,但電解總方程式寫H2O����。,【活動探究2】鈉的制備,鈉的化學(xué)性質(zhì)很活潑,這給鈉的制取帶來一定的困難�����。 目前�,世界上生產(chǎn)金屬鈉多數(shù)用電解熔融氯化鈉的方法�。,Na+,Na+,Na+,Cl-,Cl-,Cl-,陰極,陽極,,思考 如果用惰性電極電解飽和NaCl溶液呢?,電解
5����、,電解的概念,,,親,這節(jié)課你學(xué)到了什么���?,,電解的原理,構(gòu)成電解池的條件,,電極反應(yīng)式的書寫,練習(xí),分別用惰性電極電解下列物質(zhì)的水溶液����,寫出有關(guān)的電極反應(yīng)式和總反應(yīng)式。 (1)稀硫酸 (2)鹽酸 (3)硝酸銀 (4)硫酸銅 (5)氯化鉀 (6)氫氧化鈉,陰極:4H++4e- ====2H2 ↑,陽極:4OH- -4e- ==== 2H2O+ O2↑,總反應(yīng)式:,(2)鹽酸,陰極:2H+ + 2e- ==== H2↑,陽極:2Cl- - 2e- ====Cl2↑,總反應(yīng)式:,(1)稀硫酸,(3)AgNO3溶液,4Ag+ +4e- ==== 4Ag,4OH--4e- ==== 2H2O + O2 ↑,陰極: 2Cu2++4e-====2Cu,陽極: 4OH--4e- ====2H2O +O2↑,(4)CuSO4溶液,陽極:,陰極:,總反應(yīng):,2Cl- -2e- ==== Cl2 ↑,2H+ + 2e-==== H2↑,陽極:,陰極:,總反應(yīng)式:,(5)氯化鉀溶液,(6)NaOH溶液,陽極:4OH- -4e- ==== 2H2O+O2↑,陰極:4H++4e- ====2H2↑,,�?,Cu+H2SO4 CuSO4+H2↑,課后探究,試一試: 這個反應(yīng)能在電解條件下發(fā)生嗎?,
 2018年高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 1.2 電能轉(zhuǎn)化為化學(xué)能——電解 第1課時課件5 魯科版選修4.ppt
2018年高中化學(xué) 第1章 化學(xué)反應(yīng)與能量轉(zhuǎn)化 1.2 電能轉(zhuǎn)化為化學(xué)能——電解 第1課時課件5 魯科版選修4.ppt