《九年級化學(xué)第四單元物質(zhì)構(gòu)成的奧秘 復(fù)習(xí)學(xué)案 人教版》由會員分享��,可在線閱讀��,更多相關(guān)《九年級化學(xué)第四單元物質(zhì)構(gòu)成的奧秘 復(fù)習(xí)學(xué)案 人教版(3頁珍藏版)》請在裝配圖網(wǎng)上搜索��。
1��、第四單元 《物質(zhì)構(gòu)成的奧秘》復(fù)習(xí)學(xué)案
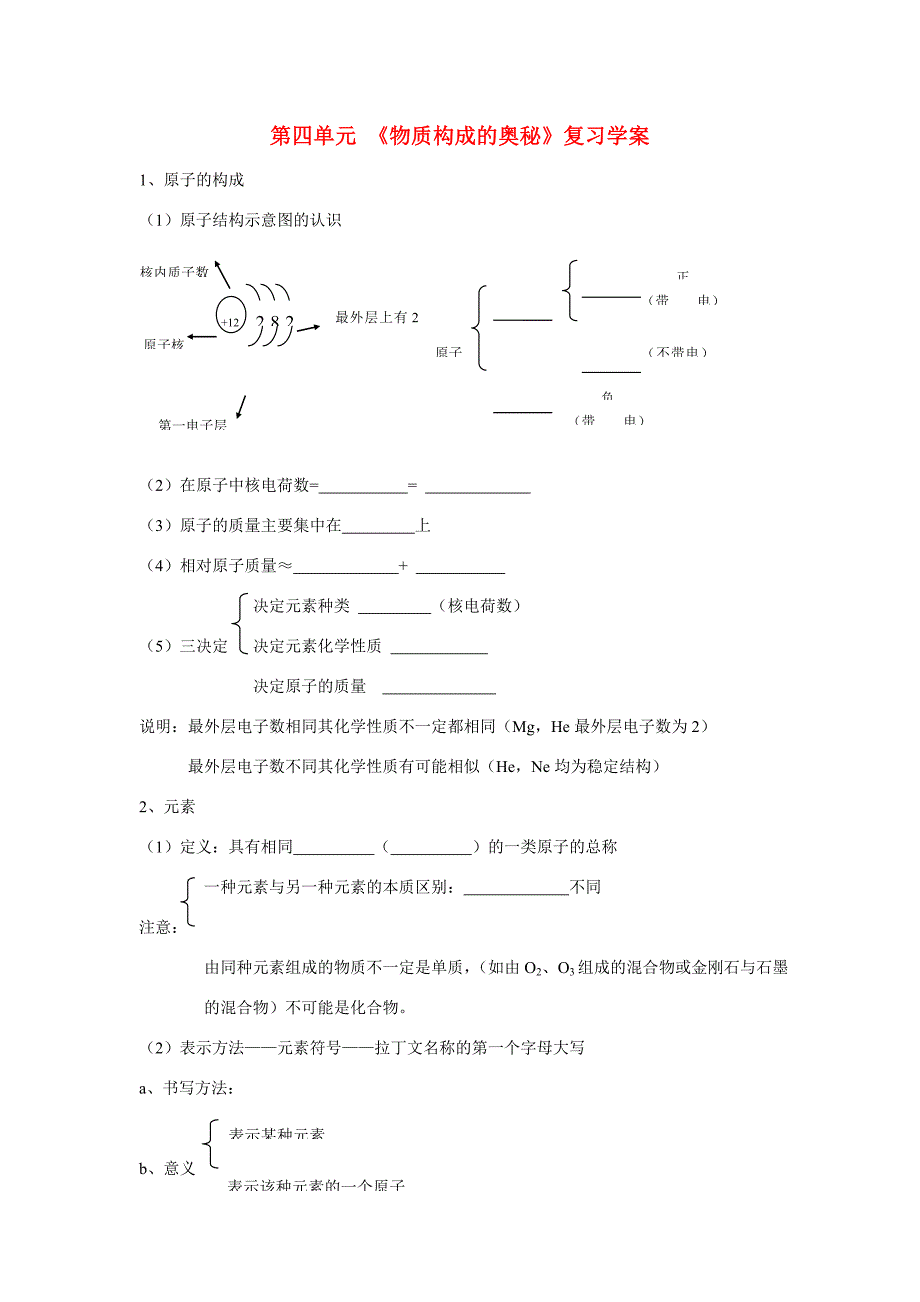
1��、原子的構(gòu)成
(1)原子結(jié)構(gòu)示意圖的認識
正
核內(nèi)質(zhì)子數(shù)
(帶 電)
最外層上有2個電子
2
8
2
+12
原子
(不帶電)電 )
原子核
負
(帶 電)
第一電子層
(2)在原子中核電荷數(shù)= =
(3) 原子的質(zhì)量主要集中在 上
(4)相對原子質(zhì)量≈ +
決定元素種類
2��、 (核電荷數(shù))
(5) 三決定 決定元素化學(xué)性質(zhì)
決定原子的質(zhì)量
說明:最外層電子數(shù)相同其化學(xué)性質(zhì)不一定都相同(Mg��,He最外層電子數(shù)為2)
最外層電子數(shù)不同其化學(xué)性質(zhì)有可能相似(He��,Ne均為穩(wěn)定結(jié)構(gòu))
2��、元素
(1)定義:具有相同 ( )的一類原子的總稱
一種元素與另一種元素的本質(zhì)區(qū)別: 不同
注意:
由同種元素組成的物質(zhì)不一定是單質(zhì)��,(如由O2��、O3組成的混合物或金剛石與石墨的混合物)不
3��、可能是化合物��。
(2)表示方法——元素符號——拉丁文名稱的第一個字母大寫
a��、書寫方法:
表示某種元素
表示該種元素的一個原子
b��、意義
注意:有些元素符號還可表示一種單質(zhì) 如Fe��、He ��、C ��、Si
在元素符號前加上數(shù)字后只能有微觀意義��,沒有宏觀意義��,如3O:只表示3個氧原子
c��、有關(guān)元素周期表
發(fā)現(xiàn):
各周期電子層數(shù)相同��,核電荷數(shù)逐漸增加
7橫行(7個周期)
各族最電外層電數(shù)相同��,電子層數(shù)逐漸增加
(化學(xué)性質(zhì)相似)
排列依據(jù)
18縱行(16族)
4��、
注:原子序數(shù)=質(zhì)子數(shù)
金屬元素:如Mg��、Al��,最外層電子數(shù)特點:<4
非金屬元素:如N��、C��,最外層電子數(shù)特點:≥4
稀有氣體元素:如He��、Ne。最外層電子數(shù)特點:2或8
d��、分類
e��、元素之最:地殼:O��、Si��、Al��、Fe 細胞:O��、C��、H
3��、離子:帶電的原子或原子團
同種元素的原子與離子比較:
①質(zhì)子數(shù)相等
②電子數(shù)及最外層電子數(shù)不同��,
③電子層數(shù)可能相同
(1)表示方法及意義:如Fe3+ :
(2)離子結(jié)構(gòu)示意圖的認識
注意:與原子示意圖的
5��、區(qū)別:質(zhì)子數(shù)=電子數(shù)則為原子結(jié)構(gòu)示意圖
質(zhì)子數(shù)>電子數(shù):則為陽離子��,如Al3+
質(zhì)子數(shù)<電子數(shù):則為陰離子��,O2--
原子數(shù)≠電子數(shù)為離子結(jié)構(gòu)示意圖
(3)與原子的區(qū)別與聯(lián)系
粒子的種類
原 子
離 子
陽離子
陰離子
區(qū)
別
粒子結(jié)構(gòu)
質(zhì)子數(shù)=電子數(shù)
質(zhì)子數(shù)>電子數(shù)
質(zhì)子數(shù)<電子數(shù)
粒子電性
不顯電性
顯正電性
顯負電性
符 號
用元素符號表示
用陽離子符號表示
用陰離子符號表示
二��、物質(zhì)的組成的表示:
+2
+2
1、化合價
a��、寫法及意義: Mg: Mg
6��、Cl2:
b��、幾種數(shù)字的含義
Fe2+ 3 Fe2+:
2H2O ��,
c��、化合物中各元素正��、負化合價的代數(shù)和為零
d��、化合價是元素的原子在形成化合物時表現(xiàn)出來的性質(zhì)��,所以單質(zhì)分子中元素化合價為0
2��、化學(xué)式
(1)寫法:
a單質(zhì):金屬��、稀有氣體及大多數(shù)固態(tài)非金屬通常用元素符號表示它們的化學(xué)式��;而氧氣��、氫氣��、氮氣��、氯氣等非金屬氣體的分子由兩個原子構(gòu)成��,其化學(xué)式表示為 ��、 ��、
��、 ��。
b化合物:正價在前��,負價在后(NH3��,CH4除外)
(2)意義:如化學(xué)式H2O的意義:4點 化學(xué)式 Fe的意義:3點
(3)計算:
a��、計算相對分子質(zhì)量=各元素的相對原子質(zhì)量×原子個數(shù)之和
b��、計算物質(zhì)組成元素的質(zhì)量比:相對原子質(zhì)量×原子個數(shù)之比
c��、計算物質(zhì)中某元素的質(zhì)量分?jǐn)?shù)
 九年級化學(xué)第四單元物質(zhì)構(gòu)成的奧秘 復(fù)習(xí)學(xué)案 人教版
九年級化學(xué)第四單元物質(zhì)構(gòu)成的奧秘 復(fù)習(xí)學(xué)案 人教版