《2014屆新人教課標(biāo)Ⅰ高三化學(xué)一輪總復(fù)習(xí)資料word版:第四章 排查落實練八》由會員分享�,可在線閱讀,更多相關(guān)《2014屆新人教課標(biāo)Ⅰ高三化學(xué)一輪總復(fù)習(xí)資料word版:第四章 排查落實練八(8頁珍藏版)》請在裝配圖網(wǎng)上搜索����。
1���、
排查落實練八 硫���、氮及其化合物
一、重要方程式的書寫
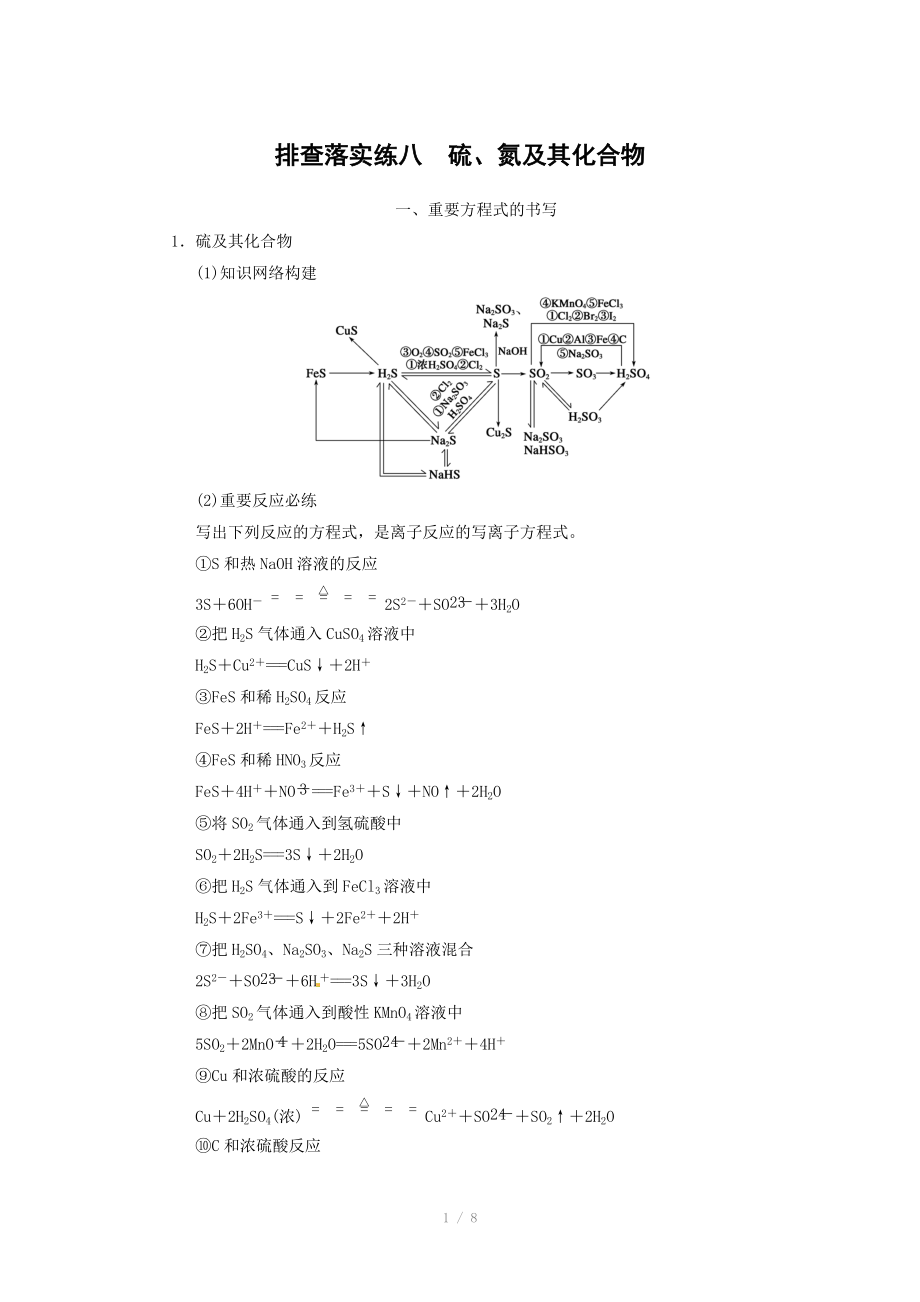
1.硫及其化合物
(1)知識網(wǎng)絡(luò)構(gòu)建
(2)重要反應(yīng)必練
寫出下列反應(yīng)的方程式����,是離子反應(yīng)的寫離子方程式。
①S和熱NaOH溶液的反應(yīng)
3S+6OH-2S2-+SO+3H2O
②把H2S氣體通入CuSO4溶液中
H2S+Cu2+===CuS↓+2H+
③FeS和稀H2SO4反應(yīng)
FeS+2H+===Fe2++H2S↑
④FeS和稀HNO3反應(yīng)
FeS+4H++NO===Fe3++S↓+NO↑+2H2O
⑤將SO2氣體通入到氫硫酸中
SO2+2H2S===3S↓+2H2O
⑥把H2S氣體通入到FeCl3
2��、溶液中
H2S+2Fe3+===S↓+2Fe2++2H+
⑦把H2SO4��、Na2SO3��、Na2S三種溶液混合
2S2-+SO+6H+===3S↓+3H2O
⑧把SO2氣體通入到酸性KMnO4溶液中
5SO2+2MnO+2H2O===5SO+2Mn2++4H+
⑨Cu和濃硫酸的反應(yīng)
Cu+2H2SO4(濃)Cu2++SO+SO2↑+2H2O
⑩C和濃硫酸反應(yīng)
C+2H2SO4(濃)CO2↑+2SO2↑+2H2O
2 / 8
?把濃H2SO4滴到Na2SO3固體上
H2SO4(濃)+Na2SO3===Na2SO4+H2O+SO2↑
?將少量NaHSO4滴到Ba(OH)
3����、2溶液中
H++SO+Ba2++OH-===BaSO4↓+H2O
?將Ba(OH)2滴加到NaHSO4溶液中至中性
Ba2++2OH-+2H++SO===BaSO4↓+2H2O
2.氮及其化合物
(1)知識網(wǎng)絡(luò)構(gòu)建
(2)重要反應(yīng)必練
寫出下列反應(yīng)的方程式��,是離子反應(yīng)的寫離子方程式��。
①N2和H2的反應(yīng)
N2+3H22NH3
②把NH3通入水中
NH3+H2ONH3H2ONH+OH-
③實驗室利用NH4Cl固體�����、Ca(OH)2固體混合加熱制備NH3
2NH4Cl+Ca(OH)22NH3↑+2H2O+CaCl2
④NH4HCO3與少量NaOH溶液的反應(yīng)
4��、HCO+OH-===CO+H2O
⑤NH4HCO3與少量Ba(OH)2溶液的反應(yīng)
Ba2++2OH-+NH+HCO===BaCO3↓+H2O+NH3H2O
⑥Mg3N2與H2O的反應(yīng)
Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
⑦Cu和稀HNO3的反應(yīng)
3Cu+8H++2NO===3Cu2++2NO↑+4H2O
⑧Cu和濃HNO3的反應(yīng)
Cu+4H++2NO===Cu2++2NO2↑+2H2O
⑨Fe和少量稀HNO3的反應(yīng)
3Fe+8H++2NO===3Fe2++2NO↑+4H2O
⑩Fe和過量稀HNO3的反應(yīng)
Fe+4H++NO===Fe3++N
5�、O↑+2H2O
?C和濃HNO3的反應(yīng)
C+4H++4NOCO2↑+4NO2↑+2H2O
?S和濃HNO3的反應(yīng)
S+4H++6NOSO+6NO2↑+2H2O
二����、值得強化記憶的實驗現(xiàn)象
1.硫在純O2中燃燒的現(xiàn)象產(chǎn)生明亮的藍紫色火焰,放出熱量���,有刺激性氣味的氣體生成����。
2.加熱NH4HCO3固體現(xiàn)象生成有刺激性氣味的氣體����,試管上有液滴生成��。
3.將SO2氣體通入到品紅溶液中再加熱的現(xiàn)象品紅溶液褪色����,加熱又恢復(fù)紅色�����。
4.加熱盛有NH4Cl固體的試管�����,現(xiàn)象NH4Cl固體分解生成氣體����,在試管口又生成白色晶體����。
5.無色試劑瓶內(nèi)的濃HNO3受日光照射,其現(xiàn)象為瓶中上部空間部分呈
6����、棕色,硝酸顯黃色���。
6.銅片和過量濃硝酸反應(yīng)的現(xiàn)象反應(yīng)劇烈��,有紅棕色氣體生成����,銅片消失,生成藍色溶液���。
7.銅片和過量稀HNO3反應(yīng)的現(xiàn)象開始反應(yīng)緩慢�,銅片上有少量氣泡產(chǎn)生�,隨著反應(yīng)的進行,反應(yīng)速率加快����,試管下端產(chǎn)生無色氣體,氣體上升變成紅棕色�����,最后銅片消失���,生成藍色溶液��。
8.把SO2氣體通入到FeCl3溶液的現(xiàn)象溶液由棕黃色變成淺綠色��。
9.將兩支蘸有濃鹽酸和濃氨水的玻璃棒相互靠近有大量白煙產(chǎn)生����。
10.將濃硫酸滴到藍礬晶體上,現(xiàn)象藍礬晶體上出現(xiàn)白斑�����。三�、簡答類語言規(guī)范再落實
1.離子檢驗
(1)檢驗Na2SO3樣品部分被氧化的實驗操作及現(xiàn)象。
答案 取樣品���,加入過量稀鹽酸
7�����、,產(chǎn)生有刺激性氣味的氣體�,通入品紅溶液,品紅溶液褪色�����;再加入BaCl2溶液����,產(chǎn)生白色沉淀���。
(2)檢驗Na2SO4中含有少量NaCl的實驗操作及現(xiàn)象。
答案 取少量樣品溶于水��,加入過量的Ba(NO3)2溶液�����,靜置����,取上層清液于試管中,再滴加AgNO3溶液�,產(chǎn)生白色沉淀,證明Na2SO4中含有少量NaCl����。
(3)NH的檢驗
試劑及用品:__________________________________________________________
操作及現(xiàn)象:__________________________________________________________
_
8、____________________________________________________________________
答案 NaOH溶液���、濕潤的紅色石蕊試紙 向所取試液中加入濃NaOH溶液��,加熱�����,把濕潤的紅色石蕊試紙放在試管口���,若試紙變藍����,說明有NH3生成����,證明原溶液含有NH
2.氣體檢驗
有下列幾瓶氣體:①NO2、②Cl2��、③HCl���、④NO���、⑤NH3�����、⑥H2S�、⑦SO2���、⑧O2、⑨H2�����、⑩CO2
(1)瓶內(nèi)氣體為紅棕色的是①�。
(2)瓶內(nèi)氣體為黃綠色的是②。
(3)打開瓶�,瓶口有白霧的是③,瓶口出現(xiàn)紅棕色氣體的是④�����。
(4)使?jié)駶櫦t色石蕊試紙變藍的是
9��、⑤���。
(5)使?jié)駶櫞姿徙U試紙變黑的是⑥�。
(6)使石灰水變渾濁的氣體是⑦⑩�,使品紅溶液褪色的是⑦。
(7)使余燼木條復(fù)燃的是⑧�。
(8)點燃產(chǎn)生爆鳴聲的是⑨。
3.氣體制備
回答下列問題�����。
有下列幾種氣體:①O2、②NH3���、③H2����、④CO2���、⑤H2S�、⑥C2H2���、⑦SO2���、⑧NO2、⑨Cl2����、⑩HCl、?NO�、?HBr���、?HI
(一)制備
(1)此裝置適用于制備①②����。
(2)此裝置適用于制備③④⑤。
(3)此裝置適用于制備①②③④⑤⑥⑦⑧?����。
(4)此裝置適用于制備⑦⑨⑩???。
(二)干燥
(1)能用濃硫酸�、P2O5干燥的是①③④⑦⑧⑨⑩?。
(2)能用
10��、堿石灰干燥的是①②③⑥?����。
4.濃硫酸為什么不能干燥NH3、H2S���、HBr�����、HI等氣體�����?
答案 濃硫酸具有酸性和強氧化性����,吸收NH3生成(NH4)2SO4,能把H2S���、HBr���、HI氧化成單質(zhì)。
5.SO2的水溶液和Cl2的水溶液均能使品紅溶液褪色����,將SO2和Cl2按1∶1體積比(同溫同壓)混合后通入品紅溶液中,品紅溶液不褪色���,其原因是___________________
______________________________________________________________________�����。
答案 SO2+Cl2+2H2O===2HCl+H2SO4����,HCl、H2
11����、SO4均不具有漂白性
6.工業(yè)上為什么常用“H2O2”作氧化劑�����?
答案 當(dāng)H2O2作氧化劑時�����,其還原產(chǎn)物為H2O����,無污染。
7.SO2能使Na2CO3溶液(滴有酚酞)�、酸性高錳酸鉀溶液、溴水�、品紅溶液褪色,原理相同嗎���?表現(xiàn)了SO2的什么性質(zhì)����?
答案 原理不相同。SO2能使Na2CO3溶液(滴有酚酞)紅色褪去�,是因為發(fā)生了反應(yīng)Na2CO3+2SO2+H2O===2NaHSO3+CO2,表現(xiàn)了SO2酸性氧化物的性質(zhì)��;SO2能使酸性高錳酸鉀溶液�����、溴水褪色��,表現(xiàn)了SO2的還原性��;SO2能使品紅溶液褪色���,表現(xiàn)了SO2的漂白性�����。
8.SO2��、漂白粉�����、活性炭��、H2O2和Na2O2都能使紅墨水褪色���,
12�����、其原理各怎樣?
答案 SO2漂白是與有色物質(zhì)化合生成不穩(wěn)定的無色物質(zhì)����,沒有發(fā)生氧化還原反應(yīng),加熱可恢復(fù)原色�����,可逆���,屬于化學(xué)變化����;漂白粉�����、H2O2和Na2O2是利用其強氧化性進行漂白,加熱不恢復(fù)原色����,不可逆,屬于化學(xué)變化��;活性炭是利用其吸附性進行漂白���,不可逆��,屬于物理變化�����。
9.加熱時����,濃硫酸和足量Zn反應(yīng)與濃硫酸和足量Cu反應(yīng)產(chǎn)生的氣體成分相同嗎�����?為什么����?
答案 氣體成分不相同�����。前者是SO2和H2的混合氣體���,而后者只是SO2氣體。隨著反應(yīng)的進行�����,濃硫酸會變成稀硫酸��,濃硫酸和Zn反應(yīng)�����,開始生成SO2�����,變稀后生成H2�����,而Cu和稀硫酸不反應(yīng)�����。
10.將等質(zhì)量的銅片分別與等體積��、過量的濃硝酸����、
13、稀硝酸反應(yīng)��,所得到的溶液前者呈綠色����,后者呈藍色,某同學(xué)提出可能是Cu2+濃度不同引起的��,你同意這種看法嗎���?________(填“同意”或“不同意”)�����,原因是______________________________
______________________________________________________________________�����。
另一同學(xué)提出溶液呈“綠色”是溶液中Cu2+與NO2共存的結(jié)果�,請你設(shè)計實驗探究此說法正確與否(簡述實驗方案和實驗現(xiàn)象及由此得出的結(jié)論):______________
____________________________________________________________________。
答案 不同意 等質(zhì)量的銅片與等體積��、過量的濃硝酸�����、稀硝酸反應(yīng)����,所得溶液中Cu2+的濃度基本相等 將一定量的NO2通入銅片與稀硝酸反應(yīng)后的溶液中,若溶液呈綠色�,則該同學(xué)的結(jié)論正確,反之�����,不正確
希望對大家有所幫助��,多謝您的瀏覽��!
 2014屆新人教課標(biāo)Ⅰ高三化學(xué)一輪總復(fù)習(xí)資料word版:第四章 排查落實練八
2014屆新人教課標(biāo)Ⅰ高三化學(xué)一輪總復(fù)習(xí)資料word版:第四章 排查落實練八