《浙江省溫州市龍灣區(qū)實(shí)驗(yàn)中學(xué)中考科學(xué)總復(fù)習(xí) 化學(xué)反應(yīng)的應(yīng)用課件》由會員分享���,可在線閱讀��,更多相關(guān)《浙江省溫州市龍灣區(qū)實(shí)驗(yàn)中學(xué)中考科學(xué)總復(fù)習(xí) 化學(xué)反應(yīng)的應(yīng)用課件(16頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索��。
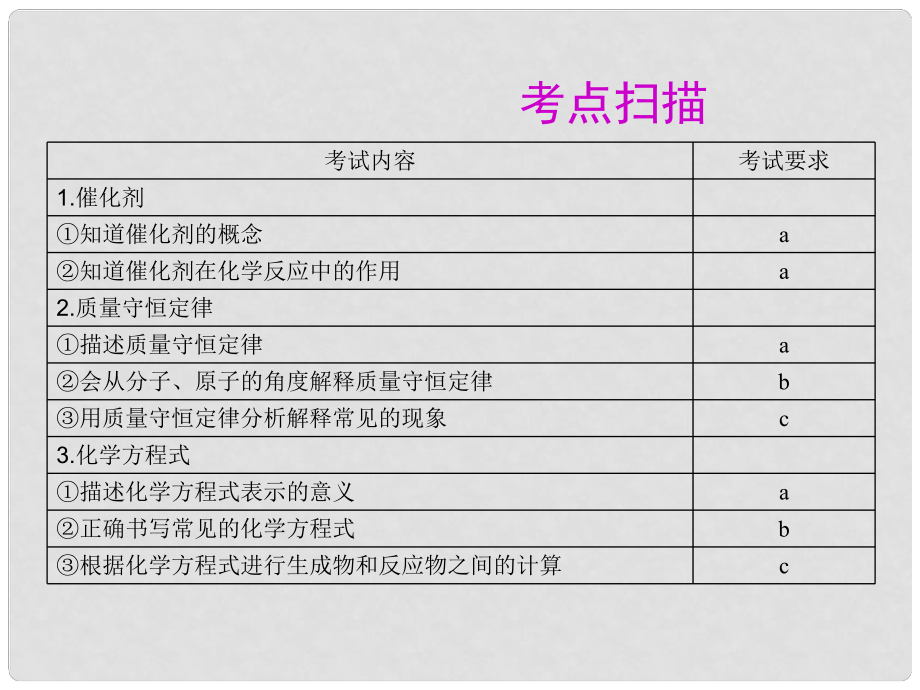
1�、考點(diǎn)掃描考試內(nèi)容考試要求1.催化劑知道催化劑的概念a知道催化劑在化學(xué)反應(yīng)中的作用a2.質(zhì)量守恒定律描述質(zhì)量守恒定律a會從分子��、原子的角度解釋質(zhì)量守恒定律b用質(zhì)量守恒定律分析解釋常見的現(xiàn)象c3.化學(xué)方程式描述化學(xué)方程式表示的意義a正確書寫常見的化學(xué)方程式b根據(jù)化學(xué)方程式進(jìn)行生成物和反應(yīng)物之間的計(jì)算c要點(diǎn)梳理 一�����、催化劑和催化作用 催化劑在化學(xué)反應(yīng)中能 其他物質(zhì)反應(yīng)速率�,其本身的 質(zhì)量和化學(xué)性質(zhì)在反應(yīng)前后都沒有改變�����。催化劑在化學(xué)變化中 起 (可加快亦可減慢)物質(zhì)反應(yīng)速率的作用�,即通常所說 的 作用�。 二、質(zhì)量守恒定律 1質(zhì)量守恒定律內(nèi)容: 的各物質(zhì)的質(zhì)量總和�����,等于 的各 物質(zhì)的質(zhì)量總和�����。 2質(zhì)量守
2��、恒定律微觀解釋: 在化學(xué)反應(yīng)前后��,原子的 沒有改變�����,原子的 也沒有增 減�����,各原子的 也沒有變化��,所以化學(xué)反應(yīng)前后各物質(zhì)的質(zhì) 量總和相等���。改變改變改變改變催化催化參加化學(xué)反應(yīng)參加化學(xué)反應(yīng)反應(yīng)后生成反應(yīng)后生成種類種類數(shù)目數(shù)目質(zhì)量質(zhì)量 三�、化學(xué)方程式 1. 化學(xué)方程式書寫原則: �����; ���。 2化學(xué)方程式表示的意義: 以 CO2 CO2 為例: (1)表示化學(xué)反應(yīng)中的反應(yīng)物和生成物�����,即反應(yīng)物是 ����,生成物是 ����。 (2)表明該化學(xué)反應(yīng)進(jìn)行的條件是 。 (3)表示了各物質(zhì)之間的質(zhì)量關(guān)系��,即反應(yīng)物和生成物之間 的質(zhì)量比:如 份質(zhì)量的碳與 份質(zhì)量的氧氣完全反 應(yīng)生成 份質(zhì)量的二氧化碳。 (4)微觀角度可表示各物質(zhì)間
3��、 比�����,如 與 完全反應(yīng)得到 �����。以客觀事實(shí)為依據(jù)以客觀事實(shí)為依據(jù)遵循質(zhì)量守恒定律遵循質(zhì)量守恒定律碳和氧氣碳和氧氣二氧化碳二氧化碳點(diǎn)燃點(diǎn)燃121232324444分子分子( (或原子或原子) )個數(shù)個數(shù)1 1個碳原子個碳原子1 1個氧分子個氧分子1 1個二氧化碳分子個二氧化碳分子熱點(diǎn)聚焦 深度剖析 要點(diǎn)提示: 參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和�,等于反應(yīng)后生成的各物質(zhì)的質(zhì)量總和。在一切化學(xué)反應(yīng)里�,反應(yīng)前后原子的種類沒有改變,原子的數(shù)目也沒有增減�,各原子的質(zhì)量也沒有變化,所以化學(xué)反應(yīng)前后各物質(zhì)的質(zhì)量總和相等����。質(zhì)量守恒定律是自然界最普遍、最基本的定律�����。理解質(zhì)量守恒定律應(yīng)注意:強(qiáng)調(diào)的是“參加化學(xué)反應(yīng)”的物質(zhì)
4、質(zhì)量��,參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量不包括雖然是反應(yīng)物��,但卻未參加反應(yīng)的那部分�。對反應(yīng)后的物質(zhì)來講,強(qiáng)調(diào)“反應(yīng)生成的物質(zhì)質(zhì)量”����,生成的各物質(zhì)的質(zhì)量包括生成的沉淀和逸出的氣體��?�!百|(zhì)量守恒”不等于“體積守恒”�����。熱點(diǎn)一質(zhì)量守恒定律的應(yīng)用熱點(diǎn)一質(zhì)量守恒定律的應(yīng)用 典例分析 1 根據(jù)已配平的化學(xué)方程式: 4K2Cr2O7 4K2CrO42R3O2�,試推測R的化學(xué)式一定是( ) ACrO3 BCrO CCrO2 DCr2O3 解析:在化學(xué)反應(yīng)過程中,原子種類和原子數(shù)目都不改 變���,這是解決此題的關(guān)鍵���。由此可推知R的化學(xué)式為 Cr2O3。 答案:D對點(diǎn)訓(xùn)練 1(2011寧波)將一定量的苯(C6H6)和氧氣置于一個
5、完全封 閉的容器中引燃���,反應(yīng)生成二氧化碳�、水和一種未知物 X���。測得反應(yīng)前后物質(zhì)的質(zhì)量如下表:物質(zhì)苯氧氣二氧化碳水X反應(yīng)前質(zhì)量/g3.99.6000反應(yīng)后質(zhì)量/g006.62.7m下列判斷正確的是下列判斷正確的是 ( )( )A A表中表中m的值為的值為13.5 B13.5 B該反應(yīng)屬于分解反應(yīng)該反應(yīng)屬于分解反應(yīng)C C物質(zhì)物質(zhì)X能在氧氣中燃燒能在氧氣中燃燒 D D物質(zhì)物質(zhì)X中一定含有氫元素中一定含有氫元素答案答案: :C熱點(diǎn)二正確書寫化學(xué)方程式 要點(diǎn)提示: 書寫化學(xué)方程式應(yīng)遵循客觀事實(shí)和質(zhì)量守恒定律兩大原則���。同時還要正確書寫反應(yīng)物和生成物的化學(xué)式,根據(jù)質(zhì)量守恒定律配平方程式���,寫明反應(yīng)的條件��,標(biāo)出
6����、生成物狀態(tài)的符號�。 典例分析 2 提純混有硫酸的硫酸鐵溶液,可在該溶液中加入足量_試劑后����,過濾。上述過程中發(fā)生反應(yīng)的化學(xué)方程式為_�����。 解析:本題屬除雜類問題,所加試劑能與硫酸反應(yīng)��,不能與硫酸鐵反應(yīng)�,而且除去硫酸,又不能產(chǎn)生新的雜質(zhì)�����。 答案:氫氧化鐵或氧化鐵�����; 3H2SO42Fe(OH)3 =Fe2(SO4)36H2O對點(diǎn)訓(xùn)練 2(2010湖州)某科學(xué)興趣小組查閱資料得知鎂可在氮?dú)庵腥紵蒑g3N2���,設(shè)計(jì)了如下方案進(jìn)行驗(yàn)證。熱點(diǎn)三根據(jù)化學(xué)方程式進(jìn)行計(jì)算 要點(diǎn)提示: 根據(jù)化學(xué)方程式進(jìn)行計(jì)算的一般步驟:設(shè)未知數(shù)寫出配平的化學(xué)方程式寫出有關(guān)物質(zhì)的質(zhì)量比和已知量列出比例式���、求解寫出簡明的答案�。根據(jù)化學(xué)
7����、方程式進(jìn)行計(jì)算要注意: 方程式必須配平�����;計(jì)算有關(guān)物質(zhì)的質(zhì)量比時式量要乘以前面的系數(shù)�����;單位必須統(tǒng)一��;如是不純物必須換算成純物質(zhì)的質(zhì)量代入計(jì)算���。 典例分析 3 為了測定某銅鋅合金中鋅的質(zhì)量分?jǐn)?shù),某同學(xué) 利用合金與稀硫酸反應(yīng)���,進(jìn)行了三次實(shí)驗(yàn)��,所得的相關(guān) 實(shí)驗(yàn)數(shù)據(jù)記錄如下(實(shí)驗(yàn)中誤差忽略不計(jì)):第一次第二次第三次所取合金的質(zhì)量(克)252550所用稀硫酸的質(zhì)量(克)120160100生成氫氣的質(zhì)量(克)0.40.40.4(1)(1)試計(jì)算銅鋅合金中鋅的質(zhì)量分?jǐn)?shù)��。試計(jì)算銅鋅合金中鋅的質(zhì)量分?jǐn)?shù)��。(2)(2)從上表數(shù)據(jù)分析�,當(dāng)所取的合金與所用稀硫酸的質(zhì)量從上表數(shù)據(jù)分析����,當(dāng)所取的合金與所用稀硫酸的質(zhì)量 比為比
8�、為_時����,表明合金中的鋅與稀硫酸恰好完全時,表明合金中的鋅與稀硫酸恰好完全 反應(yīng)����。反應(yīng)。 解析:銅鋅合金中只有鋅與稀硫酸反應(yīng)���,從第一�、二兩次實(shí)驗(yàn)數(shù)據(jù)分析���,實(shí)驗(yàn)一中鋅已完全反應(yīng),即25克��?����?筛鶕?jù)第一次產(chǎn)生的氫氣的質(zhì)量求出鋅的質(zhì)量���,再算質(zhì)量分?jǐn)?shù)����。在分析硫酸的質(zhì)量變化情況,可知第三次硫酸恰好完全反應(yīng)��,即100克����。再算出合金與稀硫酸質(zhì)量比。答案答案: :(1)(1)解:設(shè)合金中鋅的質(zhì)量為解:設(shè)合金中鋅的質(zhì)量為x���。 ZnH2SO4 ZnSO4H2 65 65 2 2 x 0.4g0.4g 652 652x0.4g0.4gx13g13g Zn% % 100%100%52%52% (2)14 (2)1413g
9��、13g15g15g 3(2010義烏)2009年12月14日�����,我市舉行了初中科學(xué)知識應(yīng)用暨探究技能比賽����,其中的葉脈標(biāo)簽制作項(xiàng)目是由選手在規(guī)定時間內(nèi)����,根據(jù)自己的創(chuàng)意設(shè)計(jì),對葉脈進(jìn)行染色����、繪畫��、裁割�����、拼接等藝術(shù)加工�。比賽時某組選手配制了200克10%的氫氧化鈉溶液��,比賽結(jié)束后他們對剩余的氫氧化鈉廢液用鹽酸進(jìn)行了中和處理��。 (1)配制上述溶液時需要?dú)溲趸c固體_克����。 (2)完全中和廢液時用去14.6%的鹽酸100克,則剩余廢液中含 氫氧化鈉溶質(zhì)多少克����?(假設(shè)廢液中的其他物質(zhì)均不與鹽酸 發(fā)生反應(yīng)) 對點(diǎn)訓(xùn)練對點(diǎn)訓(xùn)練 答案: (1)20 (2)解:設(shè)剩余廢液中含氫氧化鈉溶質(zhì)x�����。 NaOHHCl=NaCl
10�����、H2O 4036.5 x100克14.6% 40 36.5x 14.6gx16克 答:剩余廢液中含氫氧化鈉溶質(zhì)16克。易錯警示 典例分析 5 在反應(yīng)M2N=R2Q中����,3.2gM與N恰好完全反應(yīng)后,生成8.8gR��,且反應(yīng)生成的R和Q的質(zhì)量比為11 9�����,則在此反應(yīng)中M和N的相對分子質(zhì)量之比為() A1 2 B1 4 C9 16 D4 9 誤解:此題易錯選B����。 解析:根據(jù)質(zhì)量守恒定律,參加化學(xué)反應(yīng)的各物質(zhì)的質(zhì)量總和等于反應(yīng)生成的各物質(zhì)的質(zhì)量總和��,這是不需考慮具體方程式的書寫的���,而根據(jù)相對分子質(zhì)量計(jì)算物質(zhì)的質(zhì)量比是要考慮具體方程式中化學(xué)式前面的化學(xué)計(jì)量數(shù)的����,這是學(xué)生最易混淆不清的地方。正確答案選A�。 答案:A知識結(jié)構(gòu)
 浙江省溫州市龍灣區(qū)實(shí)驗(yàn)中學(xué)中考科學(xué)總復(fù)習(xí) 化學(xué)反應(yīng)的應(yīng)用課件
浙江省溫州市龍灣區(qū)實(shí)驗(yàn)中學(xué)中考科學(xué)總復(fù)習(xí) 化學(xué)反應(yīng)的應(yīng)用課件