《山東省臨清市高中化學(xué) 第3章 第2節(jié) 水的電離和溶液的酸堿性(1)課件 新人教版選修4》由會(huì)員分享���,可在線閱讀�,更多相關(guān)《山東省臨清市高中化學(xué) 第3章 第2節(jié) 水的電離和溶液的酸堿性(1)課件 新人教版選修4(15頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索���。
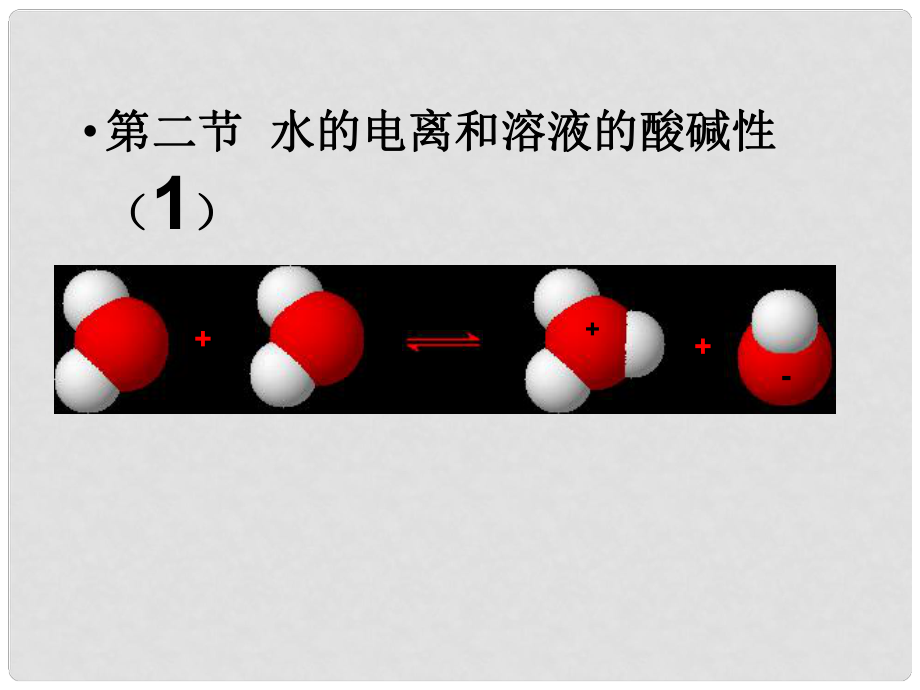
1�、第二節(jié)第二節(jié) 水的電離和溶液的酸堿性水的電離和溶液的酸堿性(1) +-探究實(shí)驗(yàn)探究實(shí)驗(yàn)精確的純水導(dǎo)電實(shí)驗(yàn)精確的純水導(dǎo)電實(shí)驗(yàn)GG現(xiàn)象:現(xiàn)象:指針擺動(dòng)指針擺動(dòng)不亮不亮 靈敏電流計(jì)靈敏電流計(jì)燈泡燈泡結(jié)論:結(jié)論:水是水是 電解質(zhì)電解質(zhì) 能發(fā)生能發(fā)生 電離電離 極弱極弱微弱微弱實(shí)驗(yàn)測(cè)定:純水中實(shí)驗(yàn)測(cè)定:純水中2525 1L1L水中只有水中只有1 110107 7molmol水發(fā)生了電離水發(fā)生了電離25C 55.6107個(gè)水分個(gè)水分子才有子才有1個(gè)電離個(gè)電離一�、水的電離:一、水的電離: 1 1����、水的電離:、水的電離:K電離電離 =c(H+) c(OH-) c(H2O)c(H+) c(OH-) c(H2O)
2�����、 K K電離電離 = =為常數(shù)為常數(shù)2.水的離子積水的離子積: kw =(25時(shí)��,時(shí)���,Kw=110-14)對(duì)常溫下的純水進(jìn)行下列操作�,完成下表:對(duì)常溫下的純水進(jìn)行下列操作,完成下表: 酸堿性酸堿性 水的電離水的電離平衡移動(dòng)平衡移動(dòng)方向方向C(HC(H+ +) ) C(OHC(OH- -) )c(H+) 與與 c(OH-)大小關(guān)系大小關(guān)系KwKw變變化化加熱加熱加加HClHCl加加NaOHNaOH中性中性= =酸性酸性不變不變堿性堿性不變不變中性中性不移動(dòng)不移動(dòng)不變不變 不變不變= =不變不變加加NaClNaCl討論:討論:分析下表中的數(shù)據(jù)分析下表中的數(shù)據(jù)溫溫度度0202550100Kw1.14
3�、10-156.8110-15110-145.4710-14110-12討論:討論:根據(jù)前面所學(xué)知識(shí),水的電離會(huì)受什根據(jù)前面所學(xué)知識(shí)�����,水的電離會(huì)受什么外界條件影響��?么外界條件影響�?水的離子積又如何改變?水的離子積又如何改變��?c(H+)水水=c(OH-)水水 110-7 mol/L常溫下常溫下(2525), ,任何稀的水溶液任何稀的水溶液中總滿足:中總滿足: Kw=Kw= C(HC(H+ +) )C(OHC(OH)=1)=110101414注意注意:任何水溶液任何水溶液中(中(不論是在中性不論是在中性溶液還是在酸����、溶液還是在酸���、堿性溶液)�,堿性溶液)����,H+和和OH總是同時(shí)存在�����?���?偸峭瑫r(shí)存在�。 Kw
4、只與溫度有關(guān)�,而與濃度大小無(wú)關(guān)。只與溫度有關(guān)���,而與濃度大小無(wú)關(guān)�。如:如:KW25=10-14 KW100=10-12任何水溶液中任何水溶液中�����,水電離出���,水電離出的的 C(H+)水水C(OH)水水鞏固練習(xí)鞏固練習(xí)c c(H(H+ +) )c c(OH(OH- -) ) 思考題:在常溫下��,由水電離產(chǎn)生的思考題:在常溫下�,由水電離產(chǎn)生的C C(H H+ +)=1=11010-9-9 mol/L mol/L的溶液,則該溶液的酸堿性如何��?的溶液�,則該溶液的酸堿性如何?可能是酸性也可能是堿性可能是酸性也可能是堿性-正誤判斷正誤判斷6���、如果����、如果C H+不等于不等于COH-則溶液一定呈現(xiàn)酸堿性�����。則溶液一定呈
5��、現(xiàn)酸堿性�����。5��、在水中加酸會(huì)抑制水的電離���。、在水中加酸會(huì)抑制水的電離���。1�����、任何水溶液中都有�����、任何水溶液中都有CH+和和COH-�����。2�����、對(duì)水升高溫度�����,��、對(duì)水升高溫度�, CH+增大,酸性增強(qiáng)。增大��,酸性增強(qiáng)���。練習(xí):練習(xí):3�����、在水中加入稀鹽酸或��、在水中加入稀鹽酸或NaOH后��,水的離子積發(fā)生改變后�����,水的離子積發(fā)生改變4����、在酸堿溶液中�����,水電離出來(lái)的����、在酸堿溶液中,水電離出來(lái)的C H+和和COH-相等相等7.有含有含H+的水溶液一定是酸����;含的水溶液一定是酸;含OH-的水溶液一定是堿的水溶液一定是堿 酸性溶液中只含酸性溶液中只含H+�;堿性溶液中只含;堿性溶液中只含OH-. 二����、溶液酸堿性與二、溶液酸堿性與pHp
6����、H、溶液酸堿性的表示法�、溶液酸堿性的表示法(1 1)c c(H(H+ +) ) 和和 c c(OH(OH- -) )(2 2)c c(H(H+ +) ) 和和 c c(OH(OH- -) )都較小的稀溶液(都較小的稀溶液(1mol/L1mol/L) 用用pHpH表示。表示�����。pH = - lgpH = - lgc c(H(H+ +) ) 例:例:c(H+) = 110-7mol/Lmol/LpH = - lg10-7 = 7 2���、c c(H(H+ +) ) 和和 c c(OH(OH- -) )與溶液酸堿性與溶液酸堿性����、 pHpH的關(guān)系的關(guān)系溶液的酸堿性溶液的酸堿性c c(H(H+ +) )和和c
7、 c(OH(OH- -) )的關(guān)系的關(guān)系 pHpH酸性酸性中性中性堿性堿性常溫下常溫下c(H+) c(OH-)c(H+) = c(OH-)c(H+) c(OH-)7= 77pH=7pH=7的溶液一定是中性溶液?jiǎn)?�?的溶液一定是中性溶液?jiǎn)?��?答:不一定����,只有在常溫下才顯中性���。答:不一定���,只有在常溫下才顯中性。注意注意: H+與與OH的關(guān)系才是判斷溶液酸的關(guān)系才是判斷溶液酸堿性的依據(jù)堿性的依據(jù).3����、pH的測(cè)定方法的測(cè)定方法測(cè)定方法測(cè)定方法: pH試紙?jiān)嚰?pH計(jì)計(jì) 用法用法:用玻璃棒蘸溶液,點(diǎn)在:用玻璃棒蘸溶液��,點(diǎn)在pHpH試紙中央����,試紙中央�,半分鐘后半分鐘后與比色卡比色與比色卡比色討論:討論: pH試紙的使用試紙的使用能否直接把能否直接把pH試紙伸到待測(cè)液中�?試紙伸到待測(cè)液中?是否要先濕潤(rùn)是否要先濕潤(rùn)pH試紙后��,再將待測(cè)液滴到試紙后�,再將待測(cè)液滴到pH試紙上����?試紙上?如用濕潤(rùn)的如用濕潤(rùn)的pH試紙檢驗(yàn)待測(cè)液�,對(duì)該溶液試紙檢驗(yàn)待測(cè)液,對(duì)該溶液pH值的測(cè)定:值的測(cè)定:A���、一定有影響��、一定有影響 B��、偏大����、偏大 C�����、偏小、偏小 D��、不確定��、不確定能否用廣泛能否用廣泛pH試紙測(cè)出試紙測(cè)出pH=7.1來(lái)�?來(lái)? 標(biāo)準(zhǔn)比色卡中的數(shù)據(jù)都是整數(shù)標(biāo)準(zhǔn)比色卡中的數(shù)據(jù)都是整數(shù)方法二:用方法二:用pH計(jì)測(cè)定計(jì)測(cè)定
 山東省臨清市高中化學(xué) 第3章 第2節(jié) 水的電離和溶液的酸堿性(1)課件 新人教版選修4
山東省臨清市高中化學(xué) 第3章 第2節(jié) 水的電離和溶液的酸堿性(1)課件 新人教版選修4