《人教版九年級化學下冊第十一單元課題1 生活中常見的鹽——復分解反應及發(fā)生的條件專題講解(無答案)》由會員分享�,可在線閱讀�,更多相關《人教版九年級化學下冊第十一單元課題1 生活中常見的鹽——復分解反應及發(fā)生的條件專題講解(無答案)(5頁珍藏版)》請在裝配圖網(wǎng)上搜索。
1�、復分解反應及鹽的化學性質
活動一、探究復分解反應
一�����、請根據(jù)以前學過的知識,填寫下列表格���。
反應類型
反應物質
化學方程式
生成物相同點
①酸+堿
NaOH + H2SO4
HCl+ KOH
②酸+鹽
HCl+ Na2CO3
HCl+ CaCO3
③堿+鹽
Ca(OH)2+Na2CO3
CuSO4+NaOH
④鹽+鹽
AgNO3+NaCl
BaCl2+CuSO4
問題:
①化學反應根據(jù)生成物�����、反應物的物質類別和種類劃分為化合反應�����、分解反應、置換反應���、復分解反應�����,上表中的這些反應屬于哪
2�����、一種類型的反應�����?
②上述反應的反應物和生成物的物質類別有什么特點�?
③上面這些反應發(fā)生在哪些物質之間?
④復分解反應通常發(fā)生在酸��、堿����、鹽之間,那么酸����、堿、鹽之間是否一定能發(fā)生復分解反應呢���?
⑤前面學過的酸堿中和反應是否也屬于復分解反應�����?
二��、復分解反應
1.定義:兩種化合物互相交換成分�,生成另外兩種化合物的反應。
2.特點:
①在水溶液中互相交換離子;
②元素化合價不變�����。
3.復分解發(fā)生反應的條件(具備下列三個條件中的任意一個)
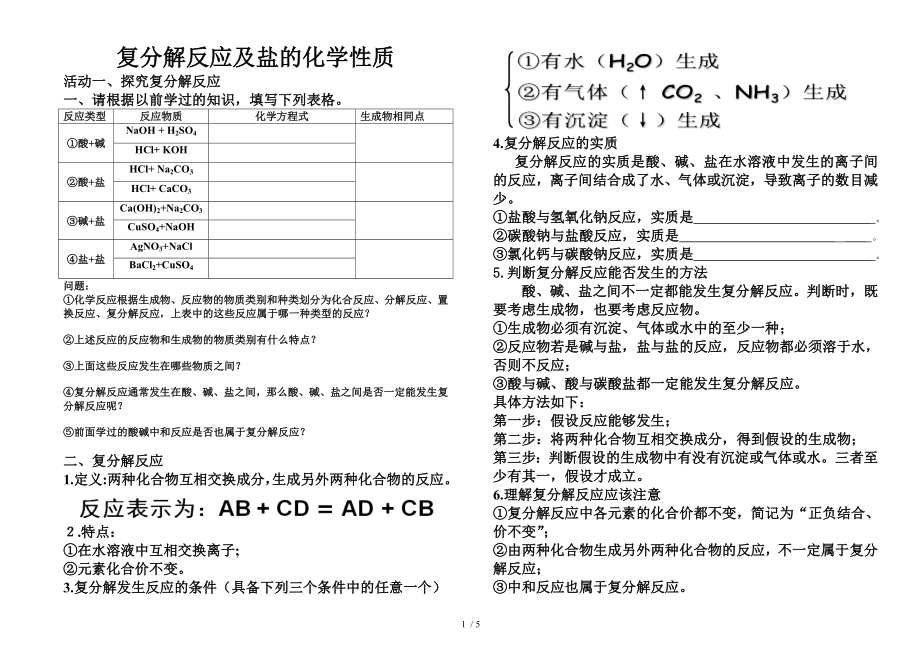
4.復分解反應的實質
復分解反應的實質是酸�����、堿�����、鹽在水溶液中發(fā)生的離子間的反應�,離子間結合成了水、氣體或沉
3�����、淀�����,導致離子的數(shù)目減少�。
①鹽酸與氫氧化鈉反應�,實質是_________________________________ 。
②碳酸鈉與鹽酸反應,實質是_____________________________ ____ �。
③氯化鈣與碳酸鈉反應,實質是_________________________________ �。
5.判斷復分解反應能否發(fā)生的方法
酸、堿���、鹽之間不一定都能發(fā)生復分解反應��。判斷時����,既要考慮生成物��,也要考慮反應物���。
①生成物必須有沉淀����、氣體或水中的至少一種���;
②反應物若是堿與鹽�,鹽與鹽的反應���,反應物都必須溶于水�,否則不反應;
③酸與堿����、酸與碳酸鹽都一定能
4、發(fā)生復分解反應�����。
具體方法如下:
第一步:假設反應能夠發(fā)生��;
第二步:將兩種化合物互相交換成分�����,得到假設的生成物��;
第三步:判斷假設的生成物中有沒有沉淀或氣體或水�。三者至少有其一,假設才成立�。
6.理解復分解反應應該注意
①復分解反應中各元素的化合價都不變,簡記為“正負結合�、價不變”����;
②由兩種化合物生成另外兩種化合物的反應�����,不一定屬于復分解反應�����;
③中和反應也屬于復分解反應��。
7.酸�����、堿�����、鹽的溶解性
物質溶解性口訣:
鉀鈉銨鹽均可溶����,
硝酸鹽遇水影無蹤���;
鹽酸鹽不溶銀亞汞���,
硫酸鹽不
5�、溶鋇和鉛�;
碳磷酸鹽多不溶;
多數(shù)酸溶少堿溶��,
只有鉀鈉銨鋇溶�����。
8.復分解反應的五種情況
9.離子共存
溶液中離子能大量共存��,是指離子間不發(fā)生反應��;離子不能共存�����,是指離子因發(fā)生反應而結合成了沉淀�、氣體或水。
①與H+不共存的離子有:______________ ___ �����,________________ _ �����,_________________________ ���。
②與OH-不共存的離子有:_________________ ����,___ _______ �����,___________ _
6�����、�,______________ _____ ,______________________ �,
_____________________ ,______________________ �。
③彼此結合成沉淀的金屬離子與酸根離子不共存,例如:
_______________ ____�,_________________ _ _,________ _____ �。
活動二����、探究鹽的化學性質
1.金屬+鹽→新鹽+新金屬
Fe + CuSO4 = Cu + FeSO4
2Al +3CuSO4 = 3Cu + Al2(SO4)3
反應條件:金屬排在鹽中金屬前面�,鹽溶
7、于水�����。
2.酸+鹽→新酸+新鹽
CaCO3 +2HCl= CaCl2 + CO2↑+ H2O
BaCl2+H2SO4=BaSO4 ↓+2HCl
反應條件:有水或者沉淀或者氣體生成
3.堿+鹽→新堿+新鹽
Na2CO3 +Ca(OH)2= 2NaOH + CaCO3↓
CuSO4+2NaOH= Na2SO4 + Cu(OH)2↓
反應條件:反應物溶于水���,生成物中有水或者沉淀或者氣體生成�。
4.鹽+鹽→新鹽+新鹽
CuSO4+BaCl2 =CuCl2+BaSO4 ↓
Na2CO3 +CaCl2 = 2NaCl + CaCO3↓
反應條件:反應物溶于水�����,生成物中有沉淀生
8���、成�����。
活動三���、探究物質的分類
活動四���、一張圖(單質、氧化物��、酸�����、堿�����、鹽關系圖)
例題講解
例1.下列化學反應不是復分解反應的是( )
A.CaCO3+2HCl==CaCl2+H2O +CO2↑
B.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+6HCl=2FeCl3+3H2O
D.NaOH + HNO3=NaNO3 + H2O
例2.判斷下列各組物質間能否發(fā)生復分解反應����,能發(fā)生的請寫出化學方程式�,不能發(fā)生請說明理由。
(1)氧化鎂和鹽酸���;
(2)碳酸鈉和硝酸�����;
(3)氯化鎂和氫氧化鈉�;
(4)碳酸鈉和硝酸鉀;
(5)氯化鈉和氫氧化鋇�。
9、
例3.下列各組離子能共存的是( )
A�����、Ba2+�����、K+��、NO3-���、CO32-�����、H+
B��、K+���、Cl-、Mg2+、NO3-���、H+
C�、Fe3+����、SO42-、OH-��、Na+����、Cu2+
D����、Ag+、Ba2+����、Cl-、NO3-�����、K+
課堂練習
1.判斷下列復分解反應能否發(fā)生;能發(fā)生的寫出化學方程式��,不能發(fā)生的說明理由����。
(1)Ca(OH)2 + HCl─
(2)NaCl + HNO3─
(3)CuCl2 + NaOH ─
(4)CaCO3+ Ba(OH)2 ─
(5)AgNO3 + KCl ─
(6)Cu(OH)2+ K2CO3 ─
2.下列各組物質的溶液混合后
10、����,不能發(fā)生反應的是( )
A.Na2CO3和H2SO4 B.NaOH和HCl
C.NaCl和H2SO4 D.AgNO3和NaCl
3.下列試劑中,能把KOH溶液�、稀硫酸、CaCl2溶液一次鑒別出來的是( )
A.KCl溶液 B.K2CO3溶液 C.NaNO3溶液 D.稀鹽酸
4.下列溶液分別能跟硫酸銅��、鹽酸���、碳酸鈉溶液反應�����,并產生不同現(xiàn)象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
5.下列各組中的物質�,
11�����、能在溶液中共存的是 ( )
A .KNO3 NaCl NaOH
B.KOH Na2CO3 HCl
C.KNO3 NaOH FeCl3
D.AgNO3 BaCl2 HNO3
6.選擇適當?shù)幕瘜W式填寫在橫線上
(1)_________+Na2CO3=2NaOH+________
(2)BaCl2+________=BaSO4↓+_________
(3)________+2HCl=_______+_______+CO2↑
活動五、酸���、堿�、鹽總結
1
12����、.酸、堿���、鹽的水溶液顏色
①銅鹽溶液一般呈藍色(含Cu2+的鹽如CuSO4���、Cu(NO3)2等)
②鐵鹽溶液一般呈黃色 (含F(xiàn)e3+的鹽如FeCl3、Fe2(SO4)3等)
③亞鐵鹽溶液一般呈淺綠色 (含F(xiàn)e2+的鹽如FeCl2��、FeSO4等)
④其它鹽溶液一般為無色
2.特殊反應現(xiàn)象
3.初中化學中幾種常見離子的檢驗
離子
所需試劑
檢驗方法
現(xiàn)象
H+
OH-
Cl-
SO42-
CO32-
13�、
NH4+
4.六對離子關系
①Ag+和Cl-反應產生不溶于稀硝酸的白色沉淀
②Ba2+和SO42-反應產生不溶于稀硝酸的白色沉淀
③H+和CO32-反應產生使石灰水變渾濁的CO2氣體
④H+和OH-反應產生水
⑤某些陽離子(Fe3+���、Cu2+)和OH-反應產生不溶于水的有色沉淀
⑥NH4+和OH-反應產生刺激性氣味的氣體-NH3
自我檢測
1.下列各組物質能夠共存的是( )
A�����、FeCl3溶液����、NaOH溶液
B、Ca(OH)2溶液���、Na2CO3溶液
C�����、BaCl2溶液���、HCl溶液
D、CaCO3�、稀HNO3
14、
2.為了證明長期暴露在空氣中的氫氧化鈉溶液 已經部分變質,實驗前請選用三種不同物質類別的試劑:________�����、________����、________。
3.除去下列物質中的雜質(括號中為雜質)�����, 請選擇正確的試劑并寫出方法:
①NaOH〖Ca(OH)2〗
試劑:________;方法:____________________________ _____ �。
②HCl〖H2SO4〗
試劑:________;方法:____________________________ _____ �。
③NaCl〖MgSO4〗
試劑:________;方法:______________________________ ___ �����。
4.推斷:a���、b�����、c����、d分別是NaNO3���、NaOH、HNO3��、Ba(NO3)2四種溶液中的一種?�,F(xiàn)利用另一種溶液X,用如圖所示的方法即將它們一一確定�����。請
寫出a���、b��、c�、d四種溶液中溶質的化學式:
a_______ ���; b________�����;c________ �;d________�。
5 / 5
 人教版九年級化學下冊第十一單元課題1 生活中常見的鹽——復分解反應及發(fā)生的條件專題講解(無答案)
人教版九年級化學下冊第十一單元課題1 生活中常見的鹽——復分解反應及發(fā)生的條件專題講解(無答案)